题目内容
16.下列关于物质的量浓度表述正确的是( )| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol•L-1的KCl饱和溶液蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
分析 A.溶液体积未知,不能确定离子物质的量;
B.氨气不一定处于标况下,22.4L氨气的物质的量不一定为1mol;
C.溶液中Na+和SO42-的物质的量相等,则c(Na+)=c(SO42-),根据溶液呈电中性,则:c(Na+)+c(K+)=2c(SO42-)+c(Cl-);
D.10℃时,100 mL 0.35 mol•L-1的KCl饱和溶液蒸发掉5g水,冷却到10℃时,剩余溶液仍为饱和溶液,溶液浓度与密度不变,溶液质量减小,则溶液体积减小.
解答 解:A.溶液体积未知,不能确定离子物质的量,故A错误;
B.氨气不一定处于标况下,22.4L氨气的物质的量不一定为1mol,故B错误;
C.若溶液中Na+和SO42-的物质的量相等,则c(Na+)=c(SO42-),根据溶液呈电中性,则:c(Na+)+c(K+)=2c(SO42-)+c(Cl-),故c(K+)=c(SO42-)+c(Cl-),故C错误;
D.10℃时,100 mL 0.35 mol•L-1的KCl饱和溶液蒸发掉5g水,冷却到10℃时,剩余溶液仍为饱和溶液,溶液浓度不变,它的物质的量浓度仍为0.35 mol•L-1,溶液密度不变,而溶液质量减小,则溶液体积减小,故D正确,
故选:D.
点评 本题考查物质的量浓度计算、溶解度、气体摩尔体积等,难度不大,注意B选项中气体摩尔体积的使用条件.

练习册系列答案
相关题目
6.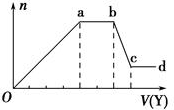 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示.(提示:铵根和偏铝酸根不能共存)
(1)若Y是盐酸,则X溶液中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,ab段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑,图中Oa段与Y溶液反应的离子的物质的量之比为【要标明离子符号,如n(Na+)】.
(2)若Y是NaOH溶液,则ab段反应的离子方程式为NH4++OH-═NH3•H2O; bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后得顺序排列】.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X溶液中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,ab段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑,图中Oa段与Y溶液反应的离子的物质的量之比为【要标明离子符号,如n(Na+)】.
(2)若Y是NaOH溶液,则ab段反应的离子方程式为NH4++OH-═NH3•H2O; bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后得顺序排列】.
 某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:
某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下: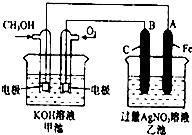 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白: ;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.
;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.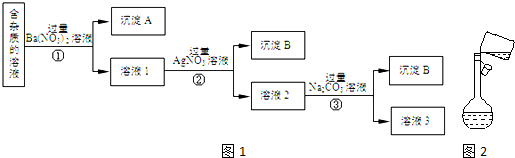
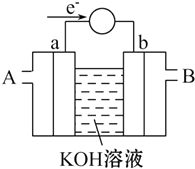 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答: