题目内容
1.化合物甲(由氮和另一种常见的主族元素组成)是一种新型无机材料.将8.2g甲溶于足量的氢氧化钠溶液,可产生标准状况下为4.48L的气体,该气体可作制冷剂.向反应后的溶液中逐滴加入稀盐酸,产生白色沉淀质量最大为15.6g,继续滴加沉淀消失.则甲溶于氢氧化钠的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑.分析 化合物甲(由氮和另一种常见的主族元素组成),溶于足量的氢氧化钠溶液,产生的气体可作制冷剂为氨气,反应后的溶滚中逐滴加入稀盐酸,先沉淀后沉淀为溶解,为铝的化合物的特征,结合相关数据推出化合物甲为氮化铝,由此分析书写化学方程式.
解答 解:化合物甲(由氮和另一种常见的主族元素组成),溶于足量的氢氧化钠溶液,产生的气体可作制冷剂为氨气,产生标准状况下为4.48L的气体,n(NH3)=$\frac{4.48L}{22.4L/mol}$=0.2mol,反应后的溶滚中逐滴加入稀盐酸,先沉淀后沉淀为溶解,为铝的化合物的特征,产生白色沉淀质量最大为15.6g,为氢氧化铝,n[Al(OH)3]=$\frac{15.6g}{78g/mol}$=0.2mol,则m(N)+m(Al)=0.2mol×14g/mol+0.2mol×27g/mol=8.2g,则8.2g甲为AlN,甲溶于氢氧化钠的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑.
点评 本题综合考查含氮化合物知识,为高频考点,侧重考查学生的分析、计算能力,题目涉及化学方程式书写,题目难度中等.

练习册系列答案
相关题目
11.若 A+酸=盐+水,则A不可能属于( )
| A. | 氧化物 | B. | 胶体 | C. | 碱 | D. | 单质 |
12.下列操作不正确的是( )
| A. | 实验室蒸馏石油时,将温度计的水银球插入液面下 | |
| B. | 稀释浓硫酸时,将浓硫酸沿玻璃棒慢慢注入盛有水的烧杯内并不断用玻璃棒搅拌 | |
| C. | 用蒸发皿蒸发液体时,未垫上石棉网直接加热蒸发皿 | |
| D. | 配制一定物质的量浓度的溶液时,清洗后未经干燥的容量瓶直接用于实验 |
9.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况,1molH2O含O原子个数为NA | |
| B. | 1.12L N2中含N2分子数为0.05NA | |
| C. | 5.6gFe与足量稀盐酸反应,转移的电子数为0.3NA | |
| D. | 0.1molFeCl3可制得Fe(OH)3胶体的数目为0.1NA |
16.下列属于酸性氧化物的是( )
| A. | 一氧化碳 | B. | 过氧化钠 | C. | 氧化铝 | D. | 二氧化硫 |
6.下列各组物质按混合物、电解质、非电解质的顺序排列的是( )
| A. | 盐酸、氢氧化钠醋酸、干冰 | B. | 澄清的石灰水、铜、氨气 | ||
| C. | 石油、水、硫酸钡 | D. | 海水、氯化钠、氧气 |
13.NaCl是一种化工原料,可以制备一系列物质,如图所示.下列说法正确的是( )
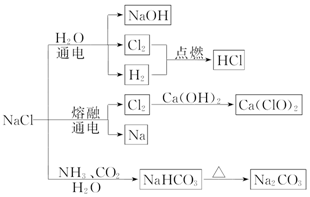

| A. | 25℃时,NaHCO3在水中的溶解度比 Na2CO3的大 | |
| B. | 石灰乳与 Cl2 的反应中,Cl2 既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的 Cl2 能用钢瓶贮运,所以 Cl2 不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
4.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ•mol-1 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1.请写出水蒸气通过红热的碳产生水煤气的热化学方程式C(s)+H2O(g)?CO(g)+H2(g)△H=+131kJ•mol-1.一定温度下,在一个容积固定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是abce(填字母编号).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2) e.容器中混合气体的密度不再改变
(2)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表中所示的三组数据:
①实验1中以v(CO2)表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸(填“吸”或“放”)热反应.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a,且a>1(用含a、b的代数式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应过程中能量的变化.
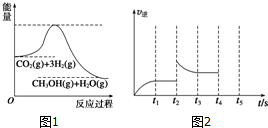
①在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使CH3OH的体积分数增大的是cde(填字母编号).
a.升高温度 b.充入He(g) c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
e.将该密闭容器改为恒压密闭容器
②容器中反应的逆反应速率随时间变化的关系如图2.t2时改变了某一种条件,改变的条件可能是升高温度.(任写一点)
(1)已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ•mol-1 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1.请写出水蒸气通过红热的碳产生水煤气的热化学方程式C(s)+H2O(g)?CO(g)+H2(g)△H=+131kJ•mol-1.一定温度下,在一个容积固定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是abce(填字母编号).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2) e.容器中混合气体的密度不再改变
(2)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表中所示的三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mi n | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a,且a>1(用含a、b的代数式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应过程中能量的变化.

①在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使CH3OH的体积分数增大的是cde(填字母编号).
a.升高温度 b.充入He(g) c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
e.将该密闭容器改为恒压密闭容器
②容器中反应的逆反应速率随时间变化的关系如图2.t2时改变了某一种条件,改变的条件可能是升高温度.(任写一点)
5.下列说法错误的是( )
| A. | 氯气的CCl4溶液不能使干燥红色布条褪色 | |
| B. | 通过化学变化可以实现16O与18O间的相互转化 | |
| C. | 为了便于运输和使用,可以将液氯储存在钢瓶(主要成分为铁)中 | |
| D. | 700℃时,4Na+CCl4=C+4NaCl,该反应属于置换反应 |