题目内容
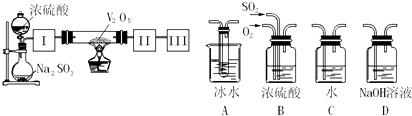
实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率.已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2.
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为 .
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:
装置Ⅰ ,装置Ⅱ ,装置Ⅲ .
(3)开始进行实验时,首先应进行的操作是 .
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会 (填“增大”、
“不变”或“减小”).
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法
是 .
(6)实验结束后,若装置Ⅱ增加的质量为b g,装置Ⅲ增加的质量为a g,则此条件下二氧化
硫的转化率是 (用含字母的代数表示).

(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:
装置Ⅰ
(3)开始进行实验时,首先应进行的操作是
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会
“不变”或“减小”).
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法
是
(6)实验结束后,若装置Ⅱ增加的质量为b g,装置Ⅲ增加的质量为a g,则此条件下二氧化
硫的转化率是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)依据热化学方程式的书写方法写出,按照热化学方程式二氧化硫的系数,计算得到放热数值,标注物质聚集状态;
(2)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,较低,可以用冰水来获得三氧化硫,Ⅲ中为吸水和尾气处理;
(3)气体的制备及性质实验中需要检查装置的气密性;
(4)根据(1)中的热化学方程式,升温平衡向逆反应方向进行判断;
(5)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收;
(6)依据硫元素守恒计算得到反应生成的三氧化硫物质的量,和剩余二氧化硫被氢氧化钠吸收的物质的量,根据转化率概念计算得到.
(2)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,较低,可以用冰水来获得三氧化硫,Ⅲ中为吸水和尾气处理;
(3)气体的制备及性质实验中需要检查装置的气密性;
(4)根据(1)中的热化学方程式,升温平衡向逆反应方向进行判断;
(5)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收;
(6)依据硫元素守恒计算得到反应生成的三氧化硫物质的量,和剩余二氧化硫被氢氧化钠吸收的物质的量,根据转化率概念计算得到.
解答:
解:(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,则2molSO2被O2氧化成气态SO3,放出196.6kJ热量,反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1;
(2)Ⅰ装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,可以用冰水来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,Ⅲ中应该加氢氧化钠溶液尾气处理装置,故答案为:B;A;D;
(3)实验前,必须进行的操作是检查装置的气密性,故答案为:检查装置的气密性;
(4)根据(1)中的热化学方程式,升温平衡向逆反应方向进行,所以SO2的转化率会减小,故答案为:减小;
(5)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收,
故答案为:继续通入氧气一段时间;
(6)已知Ⅱ增加的质量为b g即三氧化硫的质量,因此,反应生成三氧化硫的二氧化硫物质的量=
;装置Ⅲ增加的质量为a g即被氢氧化钠吸收的剩余二氧化硫物质的质量,因此,剩余的二氧化硫物质的量=
;所以二氧化硫的转化率=
×100%=
×100%,故答案为:
×100%.
(2)Ⅰ装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,可以用冰水来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,Ⅲ中应该加氢氧化钠溶液尾气处理装置,故答案为:B;A;D;
(3)实验前,必须进行的操作是检查装置的气密性,故答案为:检查装置的气密性;
(4)根据(1)中的热化学方程式,升温平衡向逆反应方向进行,所以SO2的转化率会减小,故答案为:减小;
(5)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收,
故答案为:继续通入氧气一段时间;
(6)已知Ⅱ增加的质量为b g即三氧化硫的质量,因此,反应生成三氧化硫的二氧化硫物质的量=
| bg |
| 80g/mol |
| ag |
| 64g/mol |
| ||||
|
| 4b |
| 4b+5a |
| 4b |
| 4b+5a |
点评:本题考查二氧化硫的性质、化学平衡的影响因素、计算以及热化学方程式的书写等知识,综合性较强,题目难度较大,考查学生分析和解决问题的能力,侧重实验及计算能力的考查.

练习册系列答案
相关题目
下列物质能与水反应生成强酸的是( )
| A、NH3 |
| B、CO2 |
| C、SO3 |
| D、Na2O |
下列有关溶液配制说法错误的是( )
| A、称取12.5g胆矾[CuSO4?5H2O]溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol?L-1 |
| B、取58.5gNaCl固体放入1L水中充分溶解,所得溶液中NaCl的物质的量浓度为1mol?L-1 |
| C、将100g 5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10% |
| D、将浓度为2 mol?L-1硫酸钠溶液10mL加水稀释至200mL,所得溶液浓度为0.1mol?L-1 |
根据下列化学实验事实得出的结论一定正确的是( )
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解.结论:该溶液中有SO42- |
| B、向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝.结论:该溶液中有NH4+ |
| C、向1 mL浓度均为0.05 mol?L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol?L-1的AgNO3溶液,振荡,沉淀呈黄色. 结论:Ksp(AgCl)<Ksp(AgI) |
| D、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀.结论:X中不含有醛基 |
现在加碘盐中加入的是( )
| A、碘单质 | B、碘酸钾 |
| C、碘化钾 | D、碘化银 |
室温下,将10mL pH=2的CH3COOH溶液加水稀释至1L,pH为( )
| A、4 | B、>4 | C、<4 | D、无法判断 |
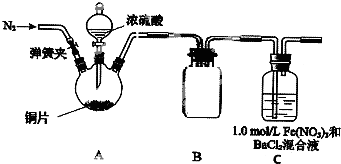 某研究小组探究SO2和Fe(NO3),溶液的反应.
某研究小组探究SO2和Fe(NO3),溶液的反应.