题目内容
实验室要用98%(ρ=1.84g?cm-3)的硫酸配制3.68mol?L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 mL;
若将原浓硫酸与等体积的水混合,所得溶液中溶质的质量分数 49%(填“<”、“=”或“>”);
若将该硫酸与等质量的水混合,所得溶液的物质的量浓度 9.2mol?L-1.
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol?L-1的硫酸溶液500mL,必须用到的实验仪器是 .
(3)若配制3.68mol?L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度偏低的是 .
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒.
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外.
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切.
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切.
E.浓硫酸稀释后立即转移到容量瓶中.
(1)需准确量取98%的硫酸
若将原浓硫酸与等体积的水混合,所得溶液中溶质的质量分数
若将该硫酸与等质量的水混合,所得溶液的物质的量浓度
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol?L-1的硫酸溶液500mL,必须用到的实验仪器是
(3)若配制3.68mol?L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度偏低的是
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒.
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外.
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切.
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切.
E.浓硫酸稀释后立即转移到容量瓶中.
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据c=
计算浓硫酸的物质的量浓度,再根据稀释定律计算需要浓硫酸的体积;
浓硫酸的密度大于水的密度,溶质的质量分数=溶质的质量÷溶液的质量×100%;
硫酸的密度大于水的密度,等质量的浓硫酸的体积小于水的体积;
(2)依据配制一定物质的量浓度溶液所需要的仪器解答;
(3)依据C=
进行误差分析,凡是能够使n减小或者使V增大的操作,所配溶液的物质的量浓度偏小,否则偏大.
| 1000ρω |
| M |
浓硫酸的密度大于水的密度,溶质的质量分数=溶质的质量÷溶液的质量×100%;
硫酸的密度大于水的密度,等质量的浓硫酸的体积小于水的体积;
(2)依据配制一定物质的量浓度溶液所需要的仪器解答;
(3)依据C=
| n |
| V |
解答:
解:(1)98%(ρ=1.84g?cm-3)的硫酸的物质的量浓度C=
=18.4mol/L,设需要浓硫酸体积为V,依据溶液稀释前后所含溶质的物质的量不变得:V×18.4mol/L=3.68mol?L-1×500ml,解得V=100.0ml;
如果等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水的密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=
,
因硫酸密度大于水的密度,则ρ1>ρ2,所以w(H2SO4)=
>49%;
浓硫酸的物质的量浓度为18.4mol/L,等质量的硫酸和水,硫酸的密度大于水,所以等质量的水的体积大于硫酸,相当于18.4mol/L的硫酸1L,加入大于1L的水,那么就是18.4mol/L除以1L加上大于1L的水,H2SO4的浓度就小于9.2mol/L;
故答案为:100;>;<;
(2)用浓硫酸配制一定物质的量浓度稀硫酸溶液所需要的仪器有:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管;
故答案为:500mL容量瓶、烧杯、玻璃棒、胶头滴管;
(3)A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒,溶质的物质的量偏小,溶液的浓度偏低;
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外,溶质的物质的量偏小,溶液的浓度偏低;
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切,吸出的溶液中含有溶质,导致溶质的物质的量偏小,溶液的浓度偏低;
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切,导致溶液的体积偏大,溶液的浓度偏低;
E.浓硫酸稀释后立即转移到容量瓶中,冷却后溶液的体积偏小,溶液的浓度偏高;
故答案为:ABCD.
| 1000×1.84g/ml×98% |
| 98g/mol |
如果等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水的密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=
| V×ρ1×98% |
| ρ1V+ρ2V |
因硫酸密度大于水的密度,则ρ1>ρ2,所以w(H2SO4)=
| V×ρ1×98% |
| ρ1V+ρ2V |
浓硫酸的物质的量浓度为18.4mol/L,等质量的硫酸和水,硫酸的密度大于水,所以等质量的水的体积大于硫酸,相当于18.4mol/L的硫酸1L,加入大于1L的水,那么就是18.4mol/L除以1L加上大于1L的水,H2SO4的浓度就小于9.2mol/L;
故答案为:100;>;<;
(2)用浓硫酸配制一定物质的量浓度稀硫酸溶液所需要的仪器有:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管;
故答案为:500mL容量瓶、烧杯、玻璃棒、胶头滴管;
(3)A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒,溶质的物质的量偏小,溶液的浓度偏低;
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外,溶质的物质的量偏小,溶液的浓度偏低;
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切,吸出的溶液中含有溶质,导致溶质的物质的量偏小,溶液的浓度偏低;
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切,导致溶液的体积偏大,溶液的浓度偏低;
E.浓硫酸稀释后立即转移到容量瓶中,冷却后溶液的体积偏小,溶液的浓度偏高;
故答案为:ABCD.
点评:本题考查了配制一定物质的量浓度的溶液,熟悉配制的原理、明确配置的步骤是解题关键,注意误差分析的技巧.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下
发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g).有关数据如表所示.则有关判断不正确的是( )
发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g).有关数据如表所示.则有关判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A、10 min内,v(Cl2)=0.04mol/(L?min) |
| B、升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| C、当容器中Cl2为1.2mol时,反应达到平衡 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2mol/L |
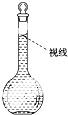 实验室需要配制0.1mol?L-1 CuSO4溶液480mL.
实验室需要配制0.1mol?L-1 CuSO4溶液480mL.
 的化学名称是2-乙基丁烷
的化学名称是2-乙基丁烷
