题目内容
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.
(1)NaCl的电子式是 .
(2)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为 .
(3)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
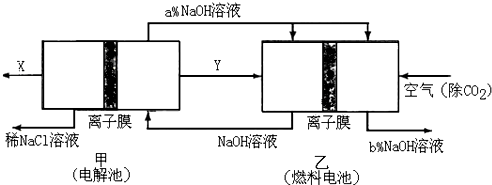
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左”或“右”)池注入.
②图中X是 (填化学式);图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母).
A.a%=b% B.a%>b% C.a%<b%
③上述设计的主要优点有(写出一个方面) .
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
下列说法中,不正确的是 (填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
(1)NaCl的电子式是
(2)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为
(3)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①经精制的饱和NaCl溶液应从图中电解池的
②图中X是
A.a%=b% B.a%>b% C.a%<b%
③上述设计的主要优点有(写出一个方面)
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
考点:氯碱工业
专题:氧化还原反应专题,元素及其化合物
分析:(1)NaCl为离子化合物,书写氯离子时注意用中括号;
(2)根据反应物和生成物写出反应方程式;
(3)①根据物质的转化情况,电解池的左池是可以得到氢氧化钠来判断饱和NaCl溶液的进入情况;
②在燃料电池中,所以通入空气的极是正极,氧气发生得电子的还原反应,通入燃料的极是负极,氢氧燃料电池最后产生的是水,能将电解质稀释,据此回答判断;
③从物质的循环利用角度来分析;
(4)a、根据氯气和水的反应平衡移动的影响因素来回答;
b、盐的水解都对水的电离起到促进作用,水解规律:越弱越水解;
c、酸的酸性越强,则pH越小,酸的电离平衡常数可以反映酸的强弱;
d、根据亚硫酸氢钠溶液显示酸性,则阴离子的电离程度大于其水解程度,据此回答判断;
e、通过对碳酸氢钠溶液进行电荷守恒和物料守恒列式即得.
(2)根据反应物和生成物写出反应方程式;
(3)①根据物质的转化情况,电解池的左池是可以得到氢氧化钠来判断饱和NaCl溶液的进入情况;
②在燃料电池中,所以通入空气的极是正极,氧气发生得电子的还原反应,通入燃料的极是负极,氢氧燃料电池最后产生的是水,能将电解质稀释,据此回答判断;
③从物质的循环利用角度来分析;
(4)a、根据氯气和水的反应平衡移动的影响因素来回答;
b、盐的水解都对水的电离起到促进作用,水解规律:越弱越水解;
c、酸的酸性越强,则pH越小,酸的电离平衡常数可以反映酸的强弱;
d、根据亚硫酸氢钠溶液显示酸性,则阴离子的电离程度大于其水解程度,据此回答判断;
e、通过对碳酸氢钠溶液进行电荷守恒和物料守恒列式即得.
解答:
解:(1)NaCl为离子化合物,有钠离子与氯离子构成,电子式为 ,故答案为:
,故答案为: ;
;
(2)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为 NaCl+H2O
NaClO+H2↑,故答案为:NaCl+H2O
NaClO+H2↑;
(3)①根据物质的转化情况,电解池的左池是电解食盐水得到的氢氧化钠,所以经精制的饱和NaCl溶液应从图中电解池的左池进入,故答案为:左;
②在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%小于b%,故答案为:Cl2;C;
③上述方案的优点之一是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗;
故答案为:燃料电池可以补充电解池消耗的电能,提高产出碱液的浓度,降低能耗;
(4)a、向氯水中加入NaHCO3,可以和盐酸之间反应,促使氯气和水的反应平衡正向移动,增大氯水中次氯酸的浓度,故a正确;
b、四种溶液中,盐中酸根离子水解程度越大,则水的电离程度越大,碱性越强,水解程度越大,即水的电离程度最大的是Na2CO3,故b错误;
c、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,酸性顺序是:H2SO3>H2CO3>HClO,pH最大的是HClO,故c错误;
d、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故d错误;
e、在NaHCO3溶液中,根据电荷守恒可得:C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①
根据物料守恒可得:C(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)②
将①②联立可得:c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故e正确.
故答案为:bcd.
 ,故答案为:
,故答案为: ;
;(2)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为 NaCl+H2O
| ||
| ||
(3)①根据物质的转化情况,电解池的左池是电解食盐水得到的氢氧化钠,所以经精制的饱和NaCl溶液应从图中电解池的左池进入,故答案为:左;
②在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%小于b%,故答案为:Cl2;C;
③上述方案的优点之一是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗;
故答案为:燃料电池可以补充电解池消耗的电能,提高产出碱液的浓度,降低能耗;
(4)a、向氯水中加入NaHCO3,可以和盐酸之间反应,促使氯气和水的反应平衡正向移动,增大氯水中次氯酸的浓度,故a正确;
b、四种溶液中,盐中酸根离子水解程度越大,则水的电离程度越大,碱性越强,水解程度越大,即水的电离程度最大的是Na2CO3,故b错误;
c、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,酸性顺序是:H2SO3>H2CO3>HClO,pH最大的是HClO,故c错误;
d、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故d错误;
e、在NaHCO3溶液中,根据电荷守恒可得:C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①
根据物料守恒可得:C(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)②
将①②联立可得:c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故e正确.
故答案为:bcd.
点评:本题考查学生电解池的工作原理以及溶液中的电离平衡和水解平衡的应用知识,属于综合知识的考查,综合性强,难度大.

练习册系列答案
相关题目
常温下,浓度均为0.1mol/L的四种溶液pH如下表依据已有的知识和信息判断,下列说法正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 4.0 |
| A、常温下,HSO3?的水解能力强于其电离能力 |
| B、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高 |
| C、Na2CO3溶液中存在以下关系:c(Na+)+c(H+)=c(CO32?)+c(HCO3?)+c(OH?) |
| D、向氯水中加入少量NaHCO3固体,不能增大HClO的浓度 |
一块钠久置后变质为1.55g钠、氧化钠、过氧化钠的混合物,将此混合物用足量的水溶解后,产生标况下气体336mL,在所得溶液中加入50mL、1mol/L的盐酸,恰呈中性.则原钠块的质量为( )
| A、0.92g |
| B、1.07g |
| C、1.15g |
| D、1.23g |
将KCl和KBr的混合物26.8g溶于水配成500mL溶液,通入过量的Cl2.反应后将溶液蒸干,得固体22.35g,则原溶液中K+、Cl-、Br-的物质的量之比是( )
| A、3:2:1 |
| B、4:3:1 |
| C、5:2:3 |
| D、5:4:1 |
“生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量.下面有关说法,不正确的是( )
| A、生物质能的缺点是严重污染环境 |
| B、生物质能源是可再生的能源 |
| C、生物质能源是解决农村能源的主要途径 |
| D、利用生物质能就是间接利用太阳能 |
碳铵(NH4HCO3)是一种常用化肥,在300℃可以分解生成氨气、水和二氧化碳.相同条件下所得混合气体的密度是H2密度的多少倍( )
| A、26.3 | B、13.2 |
| C、24 | D、12 |
下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A、2-甲基丙烷 |
| B、环戊烷 |
| C、2,2-二甲基丁烷 |
| D、2,2-二甲基丙烷 |
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.