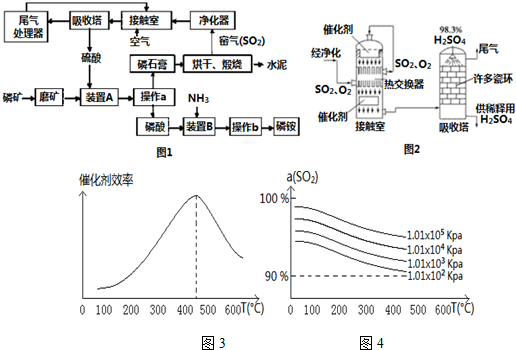
题目内容
12.醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).其制备装置及步骤如图: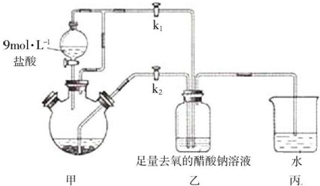
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液.
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速.
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞.
④将装置乙中混合物快速过滤、洗涤和干燥,称量.
(1)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为2Cr3++Zn═2Cr2++Zn2+.
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为关闭k1,打开k2.
(3)装置丙中导管口水封的目的是防止空气进入装置乙中氧化Cr2+.
(4)为洗涤[Cr(CH3COO)2)]2•2H2O产品,下列方法中最适合的是C.
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶
液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.4g,则该实验所得产品的产率为83.3%(不考虑溶解的醋酸亚铬水合物,Mr[Cr(CH3COO)2]2•2H2O=376g/mol).
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的空气,再加入碱液,调节pH至少为5.6才能使铬的离子沉淀完全.
【已知Cr(OH)3的溶度积为6.3×10-31,$\root{3}{63}$≈4,lg2≈0.3】
(7)一定条件下,[Cr(CH3COO)2]2•2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在.
分析 装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,生成氢气,用来增大压强把生成的CrCl2溶液压入装置乙中;装置乙:2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]2•2H2O↓,装置丙是保持装置压强平衡,同时避免空气进入.
(1)根据三颈烧瓶中发生的反应进行分析;
(2)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置3中反应;
(3)装置丙中导管口水封的目的是避免空气进入;
(4)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,据此选择洗涤试剂;
(5)CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率;
(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31计算溶液中c(OH-),再结合水的离子积计算c(H+),溶液pH=-lgc(H+);
(7)先用澄清石灰水检验二氧化碳,然后用灼热的氧化铜检验CO,据此涉及检验方案.
解答 解:(1)装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,该反应的离子反应为:2Cr3++Zn═2Cr2++Zn2+,
故答案为:2Cr3++Zn═2Cr2++Zn2+;
(2)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置乙中反应,
故答案为:关闭k1,打开k2;
(3)二价铬不稳定,极易被氧气氧化,装置丙中导管口水封的目的是避免空气进入,
故答案为:防止空气进入装置乙中氧化Cr2+;
(4)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,所以可以选用冷水和乙醚洗涤[Cr(CH3COO)2)]2•2H2O产品,
故答案为:C;
(5)CrCl3为$\frac{9.51g}{158.5g/mol}$=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]2•2H2O为0.06mol×$\frac{1}{2}$×376g/mol=11.28g,所得产品的产率为 $\frac{9.4g}{11.2g}$×100%=83.3%,
故答案为:83.3%;
(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,铬的离子沉淀完全时,浓度应小于10-5mol/L,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31,此时溶液中c(OH-)=4×10-9,溶液pH=-lgc(H+)=-lg$\frac{1{0}^{-14}}{4×1{0}^{-9}}$=5.6,
故答案为:5.6.
(7)一定条件下,[Cr(CH3COO)2]2•2H2O受热得到CO和CO2的混合气体,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,CO能够在加热条件下还原CuO,据此可检验二者,具体方法为:混合气体通入澄清石灰水,溶液变浑浊,说明混合气体中含有CO2;混合气体通入灼热的CuO,固体颜色由黑色变为红色,说明混合气体中含有CO,
答:混合气体通入澄清石灰水,溶液变浑浊,说明混合气体中含有CO2;混合气体通入灼热的CuO,固体颜色由黑色变为红色,说明混合气体中含有CO.
点评 本题考查了制备方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算等知识,注意对题目信息的提取与应用,明确实验原理、实验目的为解答关键,试题有利于培养学生分析、理解能力及化学实验能力.

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2 s内该反应的平均速率v(O2)=0.00125mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
Ⅱ、下表中的数据是破坏1mol物质中的化学键所消耗的能量:
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
(4)下列物质本身具有的能量最低的是A.
A.H2 B.Cl2 C.Br2 D.I2
(5)下列氢化物中最稳定的是A.
A.HCl B.HBr C.HI
(6)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?放热反应.
反应原理:
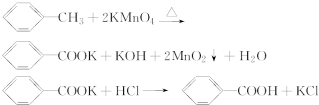
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
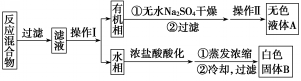
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
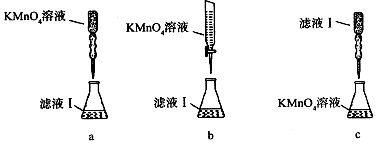
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结果 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
 配制100mL 1.0mol?L-1的氯化钠溶液过程中,
配制100mL 1.0mol?L-1的氯化钠溶液过程中,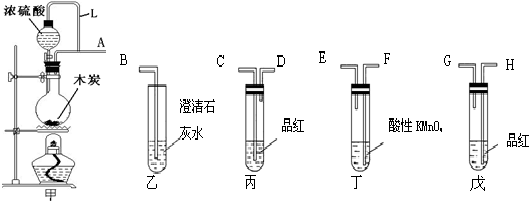

 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.