题目内容
在一个容积固定的反应器中,有一个可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应,各物质的起始加入量如下:A、B和C均为4.0mol,D为6.5mol,F为2.0mol,设E为xmol。当x在一定范围内变化时,均可以通过调节反应器的温度,可移动隔板使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置,请填写以下空白: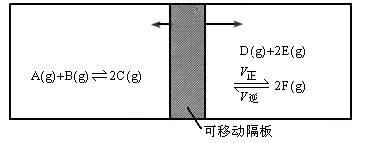
(1)若x=4.5,则右侧反应在起始时向________(填“正反应”或“逆反应”)方向进行,欲使起始反应维持向该方向进行,则x的最大取值应小于________。
(2)若x分别为4.0和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?________(填“相等”、“不相等”或“不能确定”)理由是________。
解析:
| (1)正反应,7.0
(2)不相等,因为x分别在两种不同情况下分别达平衡时,左、右两侧气体物质的量均为12,因此必须要在两种温度下才能实现。故平衡状态不同,当然A的物质的量就不相等
|
提示:
| 提示:(1)要使隔板处于反应器的中间位置,则隔板两边气体的体积必须相等,即气体的物质的量相等。由于左侧反应前后气体物质的量保持不变为12mol,而右侧当x=4.5mol时,起始的物质的量之和为6.5+4.5+2=13>12,反应需向物质的量减小方向移动才可能等于12,所以起始时向正方向进行。若维持起始时反应向正反应方向进行,设达平衡时E的转化量为amol,则由:
D(g) + 2E(g) ƒ2F(g) 起始:6.5 x 2.0 转化: 平衡: ∴ 6.5- 得a=2(x-3.5),∵ a<x(E不可能完全转化) ∴ 2(x-3.5)<x,即x<7.0。
|

 名校课堂系列答案
名校课堂系列答案在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g)△Η<0.第2min时只改变一个条件,反应情况如下表:
|
根据下列叙述回答(1)~(3)题。
在一个容积固定的反应容器有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应:
2A(g)+B(g)=2C(g) | D(g)+3E(g)=2F(g) |
各物质的起始加入量如下:A、B、C、D、E、F的物质的量分别为2mol,1mol,0 mol,Xmol,Ymol,Zmol,两边反应达平衡后,隔板恰好在正中间的位置。
(1)恒温时,若向左边容器中充入0.3mol He(He不与A、B、C、D、E、F反应),下列说法正确的是
A.A的物质的量增加 B.B的转化率增大
C.C的物质的量不变 D.F的浓度,体积分数一定都增大
(2)恒温时,若向左边容器中通人的不是He,而是2 molA和1mol B的气体,则下列说法正确的是
A.A的体积分数不变
B.B的转化率降低
C.C的体积分数、浓度都增大
D.右边容器中气体平均相对分子质量增加
(3)恒温时在(2)题的平衡体系中,若向左右两容器中同时再各注入lmolHe,平衡后与(2)题的平衡体系相比,下列说法正确的是
A.C、F的浓度都不变
B.B的转化率,F的分解率都增加了
C.A、D物质的量都增加了
D.A、B、C、D、E、F物质的量都不变

