题目内容
7.设NA为阿伏伽德罗常数的值,下列说法正确的是 ( )| A. | 在标准状况下,11.2LNO与5.6LO2混合后,所含分子数为0.5NA. | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含OH-数为0.1NA | |
| C. | 高温下,16.8g铁与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 0.1mol NaHSO4晶体中含阳离子数为0.2NA |
分析 A.N2O4存在平衡:N2O4?2NO2,部分二氧化氮转化成四氧化二氮;
B.缺少溶液体积,无法计算计算氢氧根离子数目;
C.铁与水蒸气反应生成四氧化三铁,方程式:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,结合元素化合价变化判断,
D.NaHSO4晶体中含有的阳离子为钠离子,0.1mol硫酸氢钠中含有0.1mol阳离子.
解答 解:A.在标准状况下,11.2LNO与5.6LO2混合后恰好生成11.2LNO2,物质的量为0.5mol,由于部分二氧化氮转化成四氧化二氮,则反应后分子数小于0.5NA,故A错误;
B.25℃时,pH=13的Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,没有告诉溶液体积,无法计算氢氧根离子的物质的量及数目,故B错误;
C.依据方程式:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,3mol铁与足量水蒸气失去8mol电子,16.8gFe物质的量为:$\frac{16.8g}{56g/mol}$=0.3mol,所以16.8gFe与足量水蒸气完全反应失去0.8mol电子,失去0.8NA个电子,故C正确;
D.0.1mol NaHSO4晶体中含有01mol钠离子,含阳离子数为0.2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,B为易错点,注意缺少溶液体积,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
18. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑
(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ/mol
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ/mol
则方法a中反应的热化学方程式是:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ/mol.
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
①上述装置中B电极应连D电极(填“C”或“D”)
②该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为:2Cu-2e-+2OH-=Cu2O+H2O.
③原电池中负极反应式为:N2H4-4e-+4OH-=N2↑+4H2O.
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示:
①催化剂的效率:实验①<实验②(填“>”或“<”);
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑
(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ/mol
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ/mol
则方法a中反应的热化学方程式是:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ/mol.
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
①上述装置中B电极应连D电极(填“C”或“D”)
②该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为:2Cu-2e-+2OH-=Cu2O+H2O.
③原电池中负极反应式为:N2H4-4e-+4OH-=N2↑+4H2O.
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示:
| 号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:K1=K2<K3.
12.对于反应Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述不正确的是( )
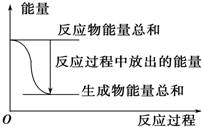

| A. | 其反应物或生成物都能用来表示该反应的速率 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若设计为原电池,当有32.5g锌溶解,标准状况下正极放出11.2L气体 |
19.氦通常被认为无法形成化合物.直到近几年,随着计算化学的发展,研究人员通过“晶体结构预测”模型进行演算发现,一定条件下能够得到氦钠化合物.经进一步实验,合成得到Na2He.下列说法不正确的是( )
| A. | Na2He中各微粒的最外层电子均达到稳定结构 | |
| B. | 合成Na2He不可能在常温常压下进行 | |
| C. | 定量研究的方法能够促进化学科学的发展 | |
| D. | He与H具有相同的电子层结构 |
17.下列由相关实验现象所推出的结论正确的是( )
| A. | 向某溶液中加入适量的 AgNO3溶液,有白色沉淀产生,则原溶液中一定有 Cl- | |
| B. | 向某溶液中加入稀盐酸无明显现象,再加 AgNO3溶液有白色沉淀产生,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入 BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入稀盐酸,无明显现象,再加 BaCl2溶液有白色沉淀产生,则原溶液中一定有SO42- |
18.下列根据实验操作和现象所得出的结论,错误的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min 后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 常温下,向浓硝酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硝酸反应 |
| C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点;氧化铝>铝 |
| D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.