题目内容
下列气体通入水中,能够发生氧化还原反应的是( )
| A、NO |
| B、SO2 |
| C、Cl2 |
| D、NH3 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:通入水中,发生的反应存在元素的化合价变化,则发生氧化还原反应,以此来解答.
解答:
解:A.NO不溶于水,也不反应,故A不选;
B.二氧化硫与水反应生成亚硫酸,没有元素的化合价变化,故B不选;
C.氯气与水反应生成HCl、HClO,Cl元素的化合价变化,发生氧化还原反应,故C选;
D.氨气与水反应生成一水合氨,没有元素的化合价变化,故D不选;
故选C.
B.二氧化硫与水反应生成亚硫酸,没有元素的化合价变化,故B不选;
C.氯气与水反应生成HCl、HClO,Cl元素的化合价变化,发生氧化还原反应,故C选;
D.氨气与水反应生成一水合氨,没有元素的化合价变化,故D不选;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、被氧化的氯原子和被还原的氯原子的物质的量之比为5:1 |
| C、NaCl是氧化产物 |
| D、氧化剂得电子数与还原剂失电子数之比为1:1 |
已知某两种物质在光照条件下能发生化学反应,其微观示意图如下:则下列说法中正确的是( )
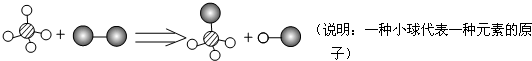

| A、图示中的反应物都是单质 |
| B、该反应属于置换反应 |
| C、图示中共有4种物质 |
| D、该图示不符合质量守恒定律 |
课堂上老师演示了向BaCl2溶液中滴加Na2SO3溶液的实验,发现有白色沉淀产生.某同学向BaCl2溶液中通入过量SO2,发现始终没有明显变化,该同学可向上述溶液中滴加下列试剂,仍然没有白色沉淀出现的是( )
| A、硝酸 | B、盐酸 |
| C、氢氧化钠溶液 | D、氨水 |
将某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是( )
| A、若V1>V2,则说明HA的酸性比HB的酸性强 |
| B、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C、若中和所得混合液的pH前者大于后者,则V1>V2 |
| D、若中和所得混合液的pH前者小于后者,则V1>V2 |
25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A、向水中加人稀醋酸,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体碳酸氢钠,c(H+)增大,Kw不变 |
| C、向水中加人少量固体CH3COONa,能促进水的电离 |
| D、压强增大,平衡向逆反应方向移动 |
