题目内容
将某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是( )
| A、若V1>V2,则说明HA的酸性比HB的酸性强 |
| B、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C、若中和所得混合液的pH前者大于后者,则V1>V2 |
| D、若中和所得混合液的pH前者小于后者,则V1>V2 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:pH均为2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗酸的体积越小,所以消耗的体积大的酸性较强;若V1>V2,则说明 HA 的酸性比HB的酸性强,若V1=V2,则说明HA的酸性与HB的酸性相同;
若中和所得混合液的pH前者大于后者,即A-离子水解程度大于B-,说明酸性HA<HB;
若中和所得混合液的pH前者小于后者,A-离子水解程度大于B-,说明酸性HA>HB.
若中和所得混合液的pH前者大于后者,即A-离子水解程度大于B-,说明酸性HA<HB;
若中和所得混合液的pH前者小于后者,A-离子水解程度大于B-,说明酸性HA>HB.
解答:
解:pH=2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗的体积越小,所以消耗的体积大的酸性较强;若V1>V2,则说明 HA 的酸性比HB的酸性强,
A、由以上分析可知,Vl>V2,则说明HA的酸性比HB的酸性强,故A正确;
B、根据A可知,若V1>V2,则说明HA的酸性比HB的酸性强,故B错误;
C、若中和所得混合液的pH前者大于后者,即A-离子水解程度大于B-,说明酸性HA<HB,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗酸的体积越小,所以消耗氢氧化钠溶液的体积:V1<V2,故C错误;
D、若中和所得混合液的pH前者小于后者,A-离子水解程度大于B-,说明酸性HA>HB,酸性越强则浓度越小,与氢氧化钠溶液反应时消耗的酸溶液的体积约答,则V1>V2,故D正确;
故选AD.
A、由以上分析可知,Vl>V2,则说明HA的酸性比HB的酸性强,故A正确;
B、根据A可知,若V1>V2,则说明HA的酸性比HB的酸性强,故B错误;
C、若中和所得混合液的pH前者大于后者,即A-离子水解程度大于B-,说明酸性HA<HB,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗酸的体积越小,所以消耗氢氧化钠溶液的体积:V1<V2,故C错误;
D、若中和所得混合液的pH前者小于后者,A-离子水解程度大于B-,说明酸性HA>HB,酸性越强则浓度越小,与氢氧化钠溶液反应时消耗的酸溶液的体积约答,则V1>V2,故D正确;
故选AD.
点评:本题考查酸性强弱的定性判断,题目难度中等,注意明确两种酸溶液中H+离子浓度相等时,酸越弱则酸的浓度越大,中和一定量的氢氧化钠溶液时消耗的体积越小的特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在下列实验中,不能达到目的是( )
| A、除去KCl中的少量MgCl2:加入适量NaOH溶液,过滤 |
| B、除去FeCl2中的少量FeCl3:加入足量铁屑,充分反应后过滤 |
| C、检测同条件H3PO4和 H2SO4溶液酸性强弱,比较磷和硫两元素非金属性的强弱. |
| D、向无色溶液加BaCl2溶液,生成白色沉淀,加稀HNO3,沉淀不消失,该溶液一定含有SO42- |
化学元素的名称,往往都有一定含义,或者是纪念发现的地点,或者是纪念某位科学家,或者是纪念发现者的故乡等.以科学家的姓氏命名的元素名称有:钔Md、锯Cm、锘No、锿Es等,其所纪念的科学家依次为( )
| A、门捷列夫、居里夫妇、诺贝尔、爱因斯坦 |
| B、门捷列夫、诺贝尔、居里夫妇、爱因斯坦 |
| C、爱因斯坦、门捷列夫、诺贝尔、居里夫妇 |
| D、爱因斯坦、门捷列夫、居里夫妇、诺贝尔 |
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体.下列叙述错误的是 ( )
| A、WX4是天然气的主要成分 |
| B、固态X2Y中含有氢键 |
| C、Y的气态氢化物比Z的气态氢化物稳定 |
| D、WY2与ZY2的晶体类型相同 |
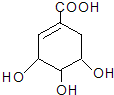 八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方--“达菲”的原材料.它的结构简式为:下列关于莽草酸的说法正确的是( )
八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方--“达菲”的原材料.它的结构简式为:下列关于莽草酸的说法正确的是( )| A、该化合物不能使溴水褪色 |
| B、该化合物可以与FeCl3溶液发生显色反应 |
| C、莽草酸的分子式为C7H8O5 |
| D、该化合物可以发生消去反应,但不可以被催化氧化生成醛 |
下列气体通入水中,能够发生氧化还原反应的是( )
| A、NO |
| B、SO2 |
| C、Cl2 |
| D、NH3 |
下列物质属于纯净物的是( )
| A、纯净的盐酸 | B、胆矾 |
| C、碘酒 | D、洁净的空气 |
