题目内容
16. 实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体14.6 g.
(3)称量.
(4)溶解、冷却,该步实验中需要使用玻璃杯,目的是搅拌,加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了保证溶质全部转移入容量瓶中.
(6)定容、摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度.
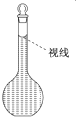
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会偏低(填“偏高”、“偏低”或“无影响”).
分析 (1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据n=cV和m=nM来计算;
(4)通过玻璃棒的搅拌可以加速溶解;
(5)洗涤烧杯并将洗涤液注入容量瓶的目的是将溶质都转移至容量瓶;
(8)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.由于无480ml的容量瓶,故选用500ml容量瓶,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
根据提供的仪器可知,还需仪器有500ml容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(2)由于无480ml的容量瓶,故选用500ml容量瓶,故配制出的溶液的体积为500ml.根据n=cV可知需要的NaCl的物质的量n=0.50mol/L×0.5L=0.25mol,质量m=nM=0.25mol×58.5g/mol=14.6g,
故答案为:14.6;
(4)溶解时,需要使用玻璃棒搅拌,加速氯化钠的溶解,
故答案为:搅拌,加速溶解;
(5)为了防止溶液溅出,要用玻璃棒引流,洗涤烧杯并将洗涤液注入容量瓶的目的是将溶质都转移至容量瓶,
故答案为:保证溶质全部转移入容量瓶中;
(8)根据图示可知,配制过程中若仰视刻度线,会导致溶液体积偏大,则浓度偏低,
故答案为:偏低.
点评 本题考查了一定物质的量浓度溶液的配制方法及误差分析,题目难度不大,明确配制过程为解答关键,注意掌握配制一定浓度的溶液步骤及误差分析的方法与技巧,试题培养了学生的化学实验能力.

| A. | ①②④⑤ | B. | 仅②⑤ | C. | 仅②④⑤ | D. | ③④⑤ |
| A. | 葡萄糖、蔗糖均能水解 | |
| B. | 福尔马林、水玻璃、一水合氨均为混合物 | |
| C. | 反应:NH4Cl (s)═NH3(g)+HCl(g)在室温下不能自发进行,说明该反应的△H>0 | |
| D. | C(石墨,s)═C (金刚石,s)△H=+1.9kJ•mol-1,说明金刚石比石墨稳定 |
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 相同条件下,1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,H2的燃烧热为241.8kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,含1molNaOH的NaOH溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
| A. | 铝的氧化物可用作于耐高温材料 | B. | Na2O2可用作漂白剂 | ||
| C. | 碱石灰可用于干燥CO2、O2等气体 | D. | 小苏打可用于治疗胃酸过多 |
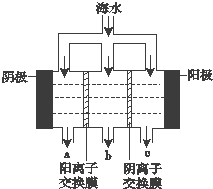 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.