题目内容
15.有以下物质:①铁红 ②Al ③C ④稀硫酸 ⑤浓硫酸 ⑥NaOH溶液⑦Al2(SO4)3(1)写出①与④反应的离子方程式Fe2O3+6H+=2Fe3++3H2O.
(2)既能跟④又能跟⑥反应的是②(填序号),写出它与⑥反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)写出写出③与⑤在加热条件下反应的化学方程式C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,下列关于该反应中⑤体现的性质说法正确的是b.
a.既体现氧化性又体现酸性 b.只体现氧化性 c.只体现酸性 d.体现吸水性.
分析 (1)①与④反应生成硫酸铁和水;
(2)上述物质中,既能跟④又能跟⑥反应的物质为Al,Al与NaOH溶液反应生成偏铝酸钠和氢气;
(3)③与⑤在加热条件下反应生成二氧化碳、二氧化硫和水,反应中S元素的化合价降低.
解答 解:(1)①与④反应生成硫酸铁和水,离子反应为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)上述物质中,既能跟④又能跟⑥反应的物质为②Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:②;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)③与⑤在加热条件下反应生成二氧化碳、二氧化硫和水,反应为C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,反应中S元素的化合价降低,只体现氧化性,
故答案为:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;b.
点评 本题考查较综合,涉及离子反应、化学反应及物质的量的计算,为高频考点,把握发生的反应及物质的量的基本计算公式为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.下列物质的水溶液因水解呈酸性的是( )
| A. | FeCl3 | B. | Na2CO3 | C. | CH3COOH | D. | KHSO4 |
6.钓鱼岛群岛的东海海域及部分太平洋海域探明为海底热水矿床.海底热水矿床是沉积着由岩浆热气从地底喷出的金、铜、锌、稀有金属等区域.下列说法正确的是( )
| A. | 金不溶于任何溶液 | |
| B. | 铜、锌在空气中均能被氧化成对应的氧化物 | |
| C. | 铜锌合金的熔点低于铜或锌的熔点 | |
| D. | ${\;}_{29}^{63}$Cu的质子数和中子数之差为34 |
3.下列化学用语的书写正确的是( )
| A. | 氮气的电子式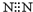 | B. | 乙烯的结构式:C2H4 | ||
| C. | 用电子式表示HCl的形成过程: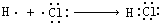 | D. | 乙醇的分子式:C2H5OH |
10.下列物质中,属于电解质的是( )
| A. | Fe | B. | H2SO4 | C. | CH4 | D. | 酒精 |
20.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
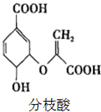

| A. | 分枝酸的分子式为C10H8O6 | |
| B. | 分枝酸能发生取代、加成、氧化反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 1mol分枝酸最多可与2molBr2发生反应 |
7.下列措施中,能加快化学反应速率的是( )
| A. | 将食物储存在冰箱里 | |
| B. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| C. | 往H2O2溶液中加入几滴FeCl3溶液 | |
| D. | 用纯锌代替粗锌与1 mol/L H2SO4溶液反应 |
5.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18g/mol | B. | 3.01×1023个SO2分子的质量为32g | ||
| C. | CH4的摩尔质量为16g | D. | 44g CO2含有的O原子数为NA |
