题目内容
20. 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3=+41kJ/mol
回答下列问题:
(1)CO2的电子式是
 .
.(2)△H1=+41kJ/mol,①反应正向的熵变△S<0(填>、<或=).
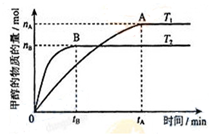
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图象如图,下列说法正确的是③④(填序号)
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=$\frac{{n}_{A}}{{t}_{A}}$mol/(L•min)
②当v(CH3OH)=v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,则容器内的压强与起始压强之比为$\frac{3}{4}$;T1温度,反应CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数数值为0.15.
分析 (1)二氧化碳中C原子和O原子间为双键,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
(2)由盖斯定律可知,将②-①可得反应③,反应前后气体体积减小,则反应熵变小于0;
(3)结合图象中甲醇的变化来计算反应速率,并利用图象中时间与速率的关系来分析T1、T2,再利用影响平衡的因素来分析解答;
(4)化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答;K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
解答 解:(1)二氧化碳中C原子和O原子间为双键,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,
,
故答案为: ;
;
(2)已知反应:①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1,
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ.mol-1
根据盖斯定律可知,将②-①可得反应③,故△H3=(-58kJ.mol-1)-(-99kJ.mol-1)=+41KJ/mol,
①反应正向是气体体积减小的反应,反应的熵变△S<0,
故答案为:+41;<;
(3)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol,反应为放热反应,则升温说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,
①v(CH3OH)=$\frac{\frac{{n}_{A}}{2l}}{{t}_{A}}$=$\frac{{n}_{A}}{2{t}_{A}}$mol/L•min,故①错误;
②当v(CH3OH)=v(H2O)时,不能证明反应正逆反应速率相同,不能说明反应达到平衡,故②错误;
③混合气体质量不变,B点温度越高平衡逆向进行,气体物质的量增大,则气体的平均相对分子质量A点大于B点,故③正确;
④处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故④正确;
故答案为:③④;
(4)由化学平衡的三段模式法计算可知,容器体积为2L,
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol/L) 1 3 0 0
变化(mol/L) 1×50% 1.5 0.5 0.5
平衡(mol/L) 0.5 1.5 0.5 0.5
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比=$\frac{0.5+1.5+0.5+0.5}{1+3}$=$\frac{3}{4}$,
平衡常数K=$\frac{0.5×0.5}{0.5×1.{5}^{3}}$=$\frac{4}{27}$=0.15
故答案为:$\frac{3}{4}$;0.15;
点评 本题综合性较强,考查知识点较多,注重了对高考热点的考查,学生应熟悉盖斯定律、热化学反应方程式、反应速率、化学平衡、原电池、图象分析判断等重要知识来解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | FeSO4溶液中滴加NaOH浓液 | B. | 碳酸氢钠溶液中滴加稀盐酸溶液 | ||
| C. | 硫酸铁溶液中滴加硫氰化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
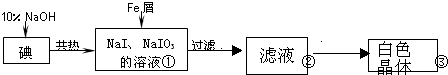
(1)碘元素位于周期表中第五周期,第ⅦA族;
(2)反应①的化学方程式3I2+6NaOH═5NaI+NaIO3+3H2O;
(3)判断反应①中碘是否已完全反应的操作是取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是隔绝空气;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性.
限选试剂:1mol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | / |
| 取少量溶液液于试管A中,加入足量的1mol/LH2SO4. | 溶液显蓝色 | 溶液中含IO3- |
| 另取少量溶液液于试管B中,滴入几滴酚酞溶液. | 溶液变红. | 溶液中含大量0H- |
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤漂白粉.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
| A. | S2-的结构示意图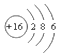 | B. | NH3结构式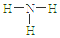 | C. | CO2的电子式: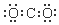 | D. | HCl电子式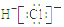 |
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
A.c(H+)B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$c(CH3COOH) C.c(H+)•c(OH-)D.$\frac{c(O{H}^{-})}{({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
 .
.