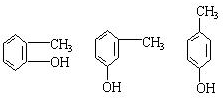
题目内容
10.某化学实验小组设计了如图1装置证明和比较SO2和氯水的漂白性,其中A装置分液漏斗中为70%的硫酸,烧瓶中为亚硫酸钠固体,B、D中为品红溶液,C中为NaOH溶液.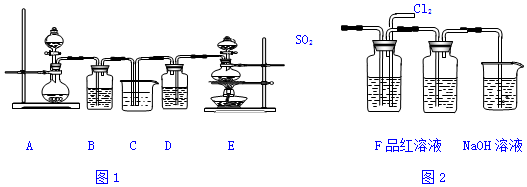
(1)实验时用装置A制备SO2气体,写出反应的化学方程式Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:B溶液恢复红色 D溶液仍无色.解释B中对应现象的原因二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红.
(3)装置C的作用是吸收多余的SO2和Cl2,防止污染环境
(4)该实验小组的甲、乙两位同学利用上述两发生装置按如图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速.
②试分析甲同学实验过程中,品红溶液不褪色的原因是:SO2+Cl2+2H2O=4H++SO42-+2Cl-(用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1).
分析 要证明和比较SO2和氯水的漂白性,需制取二氧化硫和氯气,制二氧化硫用硫酸与亚硫酸钠,不用加热,制氯气用二氧化锰和浓盐酸并加热,则A装置制二氧化硫,E装置制氯气.
(1)实验室用硫酸与亚硫酸钠制备二氧化硫;
(2)根据二氧化硫的漂白性是可逆的,而氯水的漂白性是不可逆的进行解答;
(3)二氧化硫和氯气都是有毒气体需要进行尾气处理,以免污染空气;
(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
②氯气和二氧化硫在水溶液中恰好发生氧化还原反应,转化成没有漂白性的盐酸和硫酸,所以品红溶液几乎不褪色;
③当通入的二氧化硫或者氯气一方有剩余时,又会使品红溶液褪色.
解答 解:(1)硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应,该生成的无色物质不很稳定,受热又能分解放出SO2,而恢复原来的红色,氯气使品红褪色是氧化性漂白,不可还原,无法恢复,
故答案为:溶液恢复红色;溶液仍无色;二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红;
(3)氯气和二氧化硫都有毒,不能直接排放到空气中,所以用氢氧化钠吸收过量的二氧化硫和氯气,防止污染空气,
故答案为:吸收多余的SO2和Cl2,防止污染环境;
(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
故答案为:通过观察气泡控制气体的流速;
②氯气和二氧化硫在水溶液中恰好完全反应,反应的离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
③当通入的二氧化硫或者氯气中一种气体过量,过量的氯气或者二氧化硫气体能够使品红褪色,
故答案为:控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1).
点评 本题主要考查了二氧化硫的制备以及其相关性质的综合实验,解题过程中,应围绕课本基本知识,如“二氧化硫使品红溶液褪色”、“二氧化硫与氯气反应生成氯化氢和硫酸”等基础知识,同时,对于实验的设计,尤其是多因素影响的实验,应考虑“控制变量法”.

①BF3 ②CH3═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠与盐酸反应:CO3-+2H+═H2O+CO2↑ | |
| C. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有 H+ | |
| D. | 新制的氯水能使红色布条褪色,说明氯水中含有Cl2 |
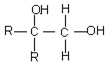 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$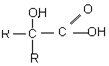

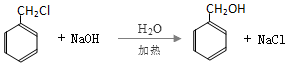 ;
;