题目内容
【题目】已知有如图所示物质相互转换关系 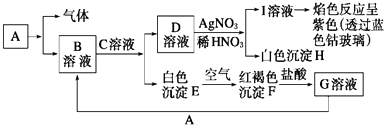
试回答:
(1)写出B的化学式 , D的化学式;
(2)写出由E转变成F的化学方程式;
(3)向G溶液中加入A的离子方程式;
向G溶液中加入铜片的离子方程式;
(4)简述B溶液中阳离子的检验方法 .
【答案】
(1)FeCl2;KCl
(2)4Fe(OH)2+O2+2H2O═4Fe(OH)3
(3)2Fe3++Fe═3Fe2+;2Fe3++Cu═2Fe2++Cu2+
(4)取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+
【解析】 解:根据框图E转化为F的明显现象,可确定E为氢氧化亚铁,F是氢氧化铁,所以G是氯化铁,I溶液的焰色反应呈紫色,说明I中含有钾离子,含有钾离子的盐D和硝酸银反应生成白色沉淀H一定是氯化银,所以D是氯化钾,进而推得A是金属铁,B是氯化亚铁,C是氢氧化,(1)B是氯化亚铁,化学式为FeCl2 , B是氯化亚铁,化学式为KCl,所以答案是:FeCl2;KCl;(2)由E转变成F的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3 , 所以答案是:4Fe(OH)2+O2+2H2O═4Fe(OH)3;(3)G是氯化铁,向G溶液中加入铁的离子方程式为 2Fe3++Fe═3Fe2+ , 向G溶液中加入铜片的离子方程式为 2Fe3++Cu═2Fe2++Cu2+ , 所以答案是:2Fe3++Fe═3Fe2+;2Fe3++Cu═2Fe2++Cu2+;(4)亚铁离子易被氧化为三价铁,溶液中是否含有亚铁离子的检验方法:取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+ , 所以答案是:取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+ .

【题目】SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为: 2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.
①a、b两点对应的平衡常数K(a)K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)c(b).
②c点时,反应速率v(正)v(逆) .
(2)电化学法处理SO2 . 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为 .
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为L(已知:1个e﹣所带电量为1.6×10﹣19C).
(3)溶液法处理SO2 . 已知常温下H2SO3和H2CO3的电离常数如表所示:
电离常数 | K1 | K2 |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
常温下,将SO2缓慢通入100mL 0.2molL﹣1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为