题目内容
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
【答案】
(1)0.3NA;0.4mol;0.45NA
(2)24L/mol
(3)0.03mol
(4)95g/mol
(5)11.2;0.6NA
【解析】解:(1)2.3g乙醇的物质的量为: ![]() =0.05mol,0.05mol乙醇分子中含义H原子的物质的量为:0.05mol×6=0.3mol,含义H原子数为0.3NA;
=0.05mol,0.05mol乙醇分子中含义H原子的物质的量为:0.05mol×6=0.3mol,含义H原子数为0.3NA;
乙醇分子中含义5个C﹣H键、1个C﹣C键、1个C﹣O键和1个O﹣H键,总共含有8个共价键,则0.05mol乙醇分子中含义共价键的物质的量为:0.05mol×8=0.4mol;
0.05mol乙醇分子中含义0.05mol羟基,0.05mol羟基中含有的电子的物质的量为:9×0.05mol=0.45mol,含有电子数为0.45NA ,
所以答案是:0.3NA;0.4mol;0.45NA;(2)8g氧气的物质的量为: ![]() =0.25mol,0.25mol氧气在该条件下的体积为6L,则该条件下的气体摩尔体积为:
=0.25mol,0.25mol氧气在该条件下的体积为6L,则该条件下的气体摩尔体积为: ![]() =24L/mol,
=24L/mol,
所以答案是:24L/mol;(3)100mL硫酸铝溶液中c(Al3+)=0.20mol/L,则该溶液中含有铝离子的物质的量为:n(Al3+)=0.20mol/L×0.1L=0.02mol,根据硫酸铝的化学式可知该溶液中含有的n(SO42﹣)= ![]() n(Al3+)=0.03mol,
n(Al3+)=0.03mol,
所以答案是:0.03mol;(4)9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 该氯化物的物质的量为:0.2mol ![]() =0.1mol,则此氯化物的摩尔质量为:
=0.1mol,则此氯化物的摩尔质量为: ![]() =95g/mol,
=95g/mol,
所以答案是:95g/mol;(5)标况下6.72L二氧化碳的物质的量为: ![]() =0.3mol,0.3mol完全反应生成二氧化碳失去的电子的物质的量为:0.3mol×(4﹣2)=0.6mol,转移电子的数目为0.6NA ,
=0.3mol,0.3mol完全反应生成二氧化碳失去的电子的物质的量为:0.3mol×(4﹣2)=0.6mol,转移电子的数目为0.6NA ,
根据电子守恒,反应生成铁的物质的量为: ![]() =0.2mol,质量为:56g/mol×0.2mol=11.2g,
=0.2mol,质量为:56g/mol×0.2mol=11.2g,
所以答案是:11.2;0.6NA .
【考点精析】解答此题的关键在于理解气体的摩尔体积的概念的相关知识,掌握单位物质的量气体所占的体积叫做气体摩尔体积.用Vm表示,Vm=V÷n.常用单位L·molˉ1.

【题目】下列实验现象所对应的离子方程式不正确的是( )
实验 | 现象 | 离子方程式 | |
A |
| 在空气里放置一段时间后溶液呈蓝色 | 4H++4I﹣+O2═2I2+2H2O |
B |
| 开始时无气泡,后来有气泡 | CO32﹣+H+═HCO3﹣ |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O |
A.A
B.B
C.C
D.D
【题目】SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为: 2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.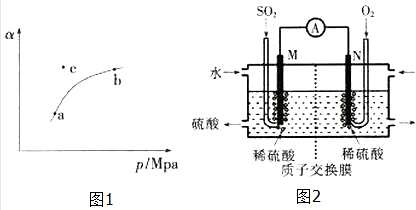
①a、b两点对应的平衡常数K(a)K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)c(b).
②c点时,反应速率v(正)v(逆) .
(2)电化学法处理SO2 . 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为 .
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为L(已知:1个e﹣所带电量为1.6×10﹣19C).
(3)溶液法处理SO2 . 已知常温下H2SO3和H2CO3的电离常数如表所示:
电离常数 | K1 | K2 |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
常温下,将SO2缓慢通入100mL 0.2molL﹣1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为
【题目】下列实验现象描述不正确的是
选项 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中 | 镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体 |
D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |