题目内容
9.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法不正确的是(| A. | 原子半径Z>W>R | |
| B. | W与X、W与Z形成的化学键类型完全相同 | |
| C. | 对应的氢化物的热稳定性:R>W | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
分析 X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,则X为H元素;Y元素的最高正价与最低负价绝对值相等,Y最外层电子数为4,Z的核电荷数是Y的2倍,故Y为C元素,Z为Mg元素;W最外层电子数是最内层电子数的3倍,则W的最外层电子数为6,故W为S元素,所以R为Cl元素,结合元素周期律与物质的结构性质判断.
解答 解:X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,则X为H元素;Y元素的最高正价与最低负价绝对值相等,Y最外层电子数为4,Z的核电荷数是Y的2倍,故Y为C元素,Z为Mg元素;W的原子序数等于Mg元素,W最外层电子数是最内层电子数的3倍,则W的最外层电子数为6,故W为S元素,所以R为Cl元素.
A.Z为Mg元素、W为S元素、R为Cl元素,同周期从左向右原子半径在减小,则原子半径为Z>W>R,故A正确;
B.W与X形成物质为H2S,含有共价键,W与Z形成的物质是MgS,属于离子化合物,含有离子键,化学键类型不同,故B错误;
C.W为S元素、R为Cl元素,非金属性Cl>S,非金属性越强,氢化物的稳定性越强,所以对应氢化物的稳定性:R>W,故C正确;
D.Y为C元素,其最高价氧化物对应的水化物是碳酸,碳酸属于弱酸,故D正确.
故选B.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意掌握金属性、非金属性强弱比较,以及最高价氧化物对应水化物的酸性的比较规律.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案
相关题目
19.下列有关非金属单质的说法正确的是( )
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
| A. | ①②③⑤⑥ | B. | ②③⑥⑦ | C. | ①②③④⑦ | D. | ①②④⑥ |
20.下列说法正确的是( )
| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
4.下列标志的高分子材料的单体,其中一种单体与其他三种单体均不是同系物的是( )
| A. |  HDPE高密度乙烯 | B. |  LDPE低密度乙烯 | C. |  DPP聚丙烯 | D. |  PS聚苯乙烯 |
14.下列说法不正确的是( )
| A. |  的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 有机硅聚醚(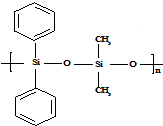 )可由单体 )可由单体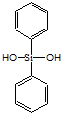 和 和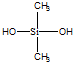 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
1.下列说法错误的是( )
| A. | CaC2含C≡C键 | B. | Mg3C2含C-C键 | C. | As4S4含As-As键 | D. | S8含S=S键 |
18.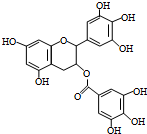 绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )
绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )
 绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )
绿茶中含有的EGCG具有抗癌作用,能使白血病中的癌细胞发生自杀性死亡.已知EGCG的结构简式如图,下列有关说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | 1mol EGCG最多可与含9mol NaOH的溶液反应 | |
| C. | EGCG在空气中易被氧化,不能与溴水发生加成反应 | |
| D. | EGCG不能与Na2CO3溶液反应 |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 32gO2所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数目为NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA | |
| D. | 1molMg变为Mg2+时失去电子的数目为2NA |



