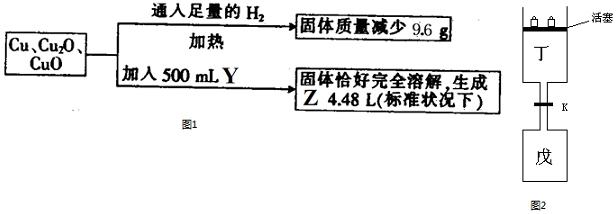
题目内容
2.已知t℃,p kPa时,在一密闭容器中充入1mol A和1mol B,保持恒温恒压下发生反应:A(g)+B(g)?C(g);△H=-Q (Q>0)达到平衡时,C的体积分数为40%.试回答有关问题:(1)A的转化率为57.1%.
(2)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2mol B,则反应达到平衡时,C的体积分数为40%.
(3)若平衡时,保持容器容积不变,使容器内压强增大,则平衡D.
A.一定向正反应方向移动B.一定向逆反应方向移动
C.一定不移动 D.不一定移动.
分析 (1)在一密闭容器中充入1mol A和1mol B,保持恒温恒压下发生反应:A(g)+B(g)?C(g);△H=-Q (Q>0)达到平衡时,C的体积分数为40%,利用三段式法计算A的转化量,进而计算转化率;
(2)恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同;
(3)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,也可能是加入其它不反应的气体引起压强的增大.
解答 解:(1)在一密闭容器中充入1mol A和1mol B,保持恒温恒压下发生反应:A(g)+B(g)?C(g);△H=-Q (Q>0)达到平衡时,C的体积分数为40%,则
A(g)+B(g)?C(g)
起始(mol)1 1 0
转化(mol)x x x
平衡(mol)1-x 1-x x
$\frac{x}{2-x}$=40%,x=0.571,
所以A的转化率为$\frac{0.571}{1}×100$=57.1%,
故答案为:57.1%;
(2)恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同,故在密闭容器中充入2mol A和2molB,反应达到平衡时C的体积分数为40%,故答案为:40%;
(3)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,若只增大A或B的浓度,平衡向正反应移动,若只增大C的浓度,平衡向逆反应移动,若同等程度增大A、B、C的浓度,平衡向正反应移动;如果是加入其它不反应的气体引起压强的增大,反应混合物的浓度不发生变化,平衡不移动,故平衡平衡可能移动,可能不移动,
故答案为:D.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析、计算能力,题目涉及影响反应速率的因素、化学平衡的有关计算、等效平衡等,难度中等,注意对等效平衡的理解.

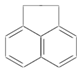 某有机物结构式如图所示,其一氯代物共有(不考虑立体异构)( )
某有机物结构式如图所示,其一氯代物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
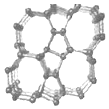
| A. | Si24是一种新型化合物 | |
| B. | Si24是硅的一种同素异形体 | |
| C. | Si24易与稀硫酸反应生成氢气 | |
| D. | 硅太阳能电池供电原理与原电池相同 |
| A. | 12.8 g | B. | 19.2 g | C. | 32.0 g | D. | 38.4 g |
反应②Fe(s)+H2O(g)═FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(2)在 900℃时反应 CO2(g)+H2(g)═CO(g)+H2O(g)的平衡常数 K=1.50.
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有BC(选填编号).
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是AC(选填编号).
A.v正(CO)=v 逆 (CO2) B.C(CO)=C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度增大;
②再通入CO2,CO2的转化率不变.
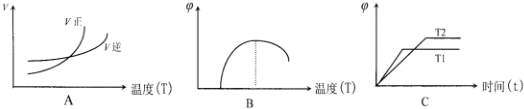
(6)下列图象符合反应①的是A(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)
 某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
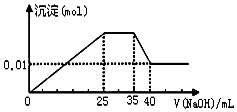
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图
根据上述实验,以下推测不正确的是( )
| A. | 依据电荷守恒,原溶液中NO3-的物质的量应为0.03mol | |
| B. | 原溶液一定不存在H+、Cu2+、CO32- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |

下列说法中不正确的是( )
| A. | 图乙中Y表示ⅡA元素的价电子数 | |
| B. | 图丁中Y表示ⅦA元素氢化物的沸点 | |
| C. | 图丙中Y表示第三周期元素的最高正化合价 | |
| D. | 图甲中Y表示F-、Na+、Mg2+、Al3+四种离子的半径 |