题目内容
2.某状况下a L氨气(此时气体摩尔体积为Vm)溶解在一定量的水中形成b mL氨水溶液,所得溶液的密度为ρ g/mL,则该氨水中氨气的物质的量浓度可表示为$\frac{1000a}{b{V}_{m}}$ mol/L.分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下aL氨气的物质的量,再根据c=$\frac{n}{V}$计算出该氨水的物质的量浓度.
解答 解:标准状况下aL氨气的物质的量为:n=$\frac{aL}{{V}_{m}}$=$\frac{a}{{V}_{m}}$mol,
该氨水的物质的量浓度为:c=$\frac{\frac{a}{{V}_{m}mol}}{b×1{0}^{-3}L}$=$\frac{1000a}{b{V}_{m}}$mol/L,
故答案为:$\frac{1000a}{b{V}_{m}}$.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与气体摩尔体积、物质的量浓度之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
12. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c{\;}^{2}(H{\;}_{2})}$,△H<0(填“>”、“<”或“=”).
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
13.下列与化学概念有关的说法正确的是( )
| A. | SiO2、P2O5、NO均为酸性氧化物 | |
| B. | NaH、NaBH4、NaClO均为离子化合物 | |
| C. | NH3.H2O是弱碱,所以NH4NO3为弱电解质 | |
| D. | 磁性氧化铁、水玻璃、液氨均为混合物 |
10.下列关于仪器使用和操作的说法中不正确的是( )
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 蒸馏时温度计水银球可以高于蒸馏烧瓶支管口 | |
| C. | 振摇分液漏斗时应关闭其玻璃塞和活塞 | |
| D. | 除去KNO3中少量NaCl:将混合物制成热的饱和溶液,冷却结晶,过滤 |
7.在标准状况下,a mol气体A分子与b mol气体B分子的质量相同.则与此有关的下列说法中正确的是( )
| A. | A与B的摩尔质量之比为a:b | |
| B. | 相同状况下,同体积的A与B的质量之比为a:b | |
| C. | 质量相同的A与B的体积之比为b:a | |
| D. | 同温同压下,A与B的密度之比为b:a |
14.${\;}_{53}^{131}$I是常规核裂变产物之一,可以通过测定大气或水中的${\;}_{53}^{131}$I含量变化来检测核电站是否发生放射性物质泄漏.下列有关${\;}_{53}^{131}$I的叙述中错误的是( )
| A. | ${\;}_{53}^{131}$I的原子核外电子数为53 | |
| B. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I互为同位素 | |
| C. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| D. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I为同种核素 |
11.下列说法中不正确的是( )
| A. | σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 非金属单质中,一定有σ键,可能有π键 | |
| D. | 一个N2分子中有1个σ键,2个π键 |
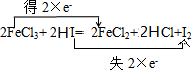 ,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.
,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.