题目内容
能用H++OH-=H2O来表示的化学反应是( )
| A、氢氧化镁和稀盐酸反应 |
| B、Ba(OH)2溶液滴入稀硫酸中 |
| C、澄清石灰水和稀硝酸反应 |
| D、醋酸溶液与氢氧化钠溶液反应 |
考点:离子方程式的书写
专题:
分析:离子方程式“H++OH-=H2O”表示强酸与可溶性强碱溶液反应生成可溶性盐和水的一类反应,酸不能为醋酸、次氯酸等弱酸,碱不能为氢氧化镁、氢氧化铜等难溶性物质,生成的盐不能为硫酸钡、碳酸钡等难溶性的盐.
解答:
解:A.氢氧化镁为难溶物,离子方程式中不能拆开,需要保留化学式,氢氧化镁与盐酸的反应的离子方程式为:Mg(OH)2+2H+=Mg2++H2O,不能用离子方程式“H++OH-=H2O”表示,故A错误;
B.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,不能用离子方程式“H++OH-=H2O”表示,故B错误;
C.澄清石灰水和稀硝酸反应,氢氧化钙需要拆开,二者反应的离子方程式为:H++OH-=H2O,故C正确;
D.醋酸为弱酸,离子方程式中醋酸需要保留分子式,醋酸与氢氧化钠溶液反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,不能用H++OH-=H2O表示,故D错误;
故选C.
B.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,不能用离子方程式“H++OH-=H2O”表示,故B错误;
C.澄清石灰水和稀硝酸反应,氢氧化钙需要拆开,二者反应的离子方程式为:H++OH-=H2O,故C正确;
D.醋酸为弱酸,离子方程式中醋酸需要保留分子式,醋酸与氢氧化钠溶液反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,不能用H++OH-=H2O表示,故D错误;
故选C.
点评:本题考查了离子方程式的书写方法,题目难度中等,注意掌握离子方程式表示的意义及离子方程式的书写原则,明确离子方程式中需要保留化学式的物质,如弱酸、难溶物、氧化物等,选项C中澄清石灰水中的氢氧化钙需要拆开,为易错点.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列化学反应中,既是离子反应,又是氧化还原反应的是( )
| A、2NaOH+H2SO4═Na2SO4+2H2O |
| B、Fe+H2SO4═FeSO4+H2↑ |
| C、BaCl2+H2SO4═BaSO4↓+2HCl |
| D、H2+CuO═Cu+H2O |
想一想:Ba(OH)2(液态)、CuSO4(固态)、纯CH3COOH这些物质为什么归为一类,下列哪些物质还可以和它们归为一类( )
| A、医用酒精 | B、HCl(气态) |
| C、水煤气 | D、豆浆 |
下列物质中,与氢气反应程度最剧烈的是( )
| A、F2 |
| B、Cl2 |
| C、Br2 |
| D、I2 |
下列各组离子在溶液中因氧化还原反应而不能大量共存的是( )
| A、Fe2+、Cl-、NO3-、K+ |
| B、Fe2+、H+、NO3-、SO42- |
| C、Al3+、Mg2+、NO3-、OH- |
| D、Fe2+、Cu2+、Cl-、NO3- |
下列离子方程式书写正确的是( )
| A、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、稀硫酸和氨水反应:H++NH3?H2O═NH4++H2O |
| C、氢氧化钠和硫酸反应:2OH-+H2SO4═SO42-+2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+═2Fe3++3Cu |
下列叙述中不正确的是( )
| A、钠原子有强还原性,钠离子有弱氧化性 |
| B、若电解熔融的氯化钠,则钠离子被氧化成钠原子 |
| C、钠很活泼,在一定条件下可以置换出金属活动性顺序表钠后面的金属 |
| D、钠是电和热的良导体 |
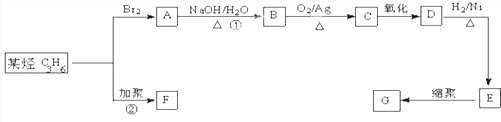
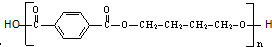 )是一种重要的工程塑料.
)是一种重要的工程塑料.
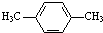 为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH
为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH 合成PBT的反应流程图为:
合成PBT的反应流程图为: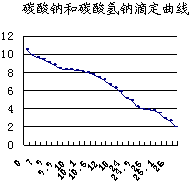 (1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用
(1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用