题目内容
3.将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合在试管中充分反应,若过滤后滤渣能被磁铁吸引,则下列有关叙述正确的是( )| A. | 溶液中肯定不存在的离子只有Cu2+ | B. | Fe3+和Cu2+均完全被铁粉还原 | ||
| C. | 滤液中滴加KSCN溶液显红色 | D. | 滤渣中肯定不含有铜 |
分析 氧化性Fe3+>Cu2+,若过滤后滤渣能被磁铁吸引,铁有剩余,一定有铜生成,三价铁离子和二价铜离子无剩余,以此解答该题.
解答 解:若过滤后滤渣能被磁铁吸引,说明固体含有铁,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的反应方程式为:2FeCl3+Fe=3FeCl2、
CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+,
故选B.
点评 本题考查了Fe3+、Cu2+的氧化能力大小的比较,为高频考点,侧重考查学生的分析能力,能正确判断固体的成分是解本题的关键,根据固体的成分了解反应的先后顺序,从而确定溶液的成分.

练习册系列答案
相关题目
10.下列实验操作正确的是( )
| A. | 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用烧杯加热分解Al(OH)3固体 | |
| D. | 用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液 |
8.下列反应不属于取代反应的是( )
| A. | 乙烷与氯气混合光照 | |
| B. | 石油裂解制丙烯 | |
| C. | 乙醇与乙酸反应制乙酸乙酯 | |
| D. | 苯与浓硝酸及浓硫酸混合加热到55℃ |
15.下列关于有机物的说法正确的是( )
| A. | 丙烷与2-甲基丙烷的一氯代物均为两种 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
12.下列反应属于取代反应的是( )
| A. | 由乙烯制取氯乙烷 | B. | 乙烷在光照下与氯气反应 | ||
| C. | 苯与H2反应 | D. | 乙醇与O2制取乙醛 |
13.根据实验室测定硫酸铜晶体(CuSO4•xH2O)结晶水含量的实验,填写下列空白.
(1)某学生实验后得到表数据:
测得平均结晶水x=4.1(保留2位小数),相对误差=18%(保留2位小数).
(2)从下列选项中选出该学生产生误差的原因可能是(填写字母)CD.
A.加热前称量时容器未完全干燥
B.加热过程中晶体有少量溅失
C.加热后容器未放入干燥器中冷却
D.硫酸铜晶体中含有不分解失重的杂质.
(1)某学生实验后得到表数据:
| 实验 序号 | 加热前的质量 | 加热后的质量 | 失水质量 | 结晶水的值 | |
| m0(容器) | m1(容器+晶体) | m2(容器+无水硫酸铜) | |||
| 1 | 35.503g | 35.685g | 35.620g | ①0.065 | ②4.9 |
| 2 | 35.503g | 35.663g | 35.606g | ③0.057 | ④3.2 |
(2)从下列选项中选出该学生产生误差的原因可能是(填写字母)CD.
A.加热前称量时容器未完全干燥
B.加热过程中晶体有少量溅失
C.加热后容器未放入干燥器中冷却
D.硫酸铜晶体中含有不分解失重的杂质.
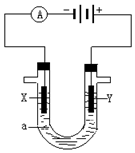 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.
人们习惯上把电解饱和食盐水的工业叫做氯碱工业.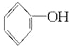 +2Na→2
+2Na→2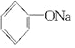 +H2↑
+H2↑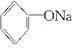 +H2O.
+H2O.