题目内容
活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:
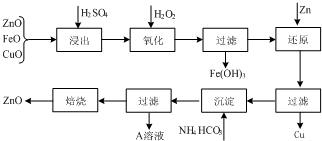
(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5g/cm3),则该H2SO4的物质的量浓度为 (保留两位小数).
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04mol?L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀.
①粗略测定溶液pH的实验操作是 .
②已知:常温下Fe(OH)3的Ksp=4.0×10-38.滤液的pH至少为 时,溶液中Fe3+开始沉淀.
(3)A溶液中主要含有的溶质是 ,验证溶质所含阳离子的方法是 .
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌.取碱式碳酸锌6.82g,溶于HCl生成CO2 448mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式 .

(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5g/cm3),则该H2SO4的物质的量浓度为
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04mol?L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀.
①粗略测定溶液pH的实验操作是
②已知:常温下Fe(OH)3的Ksp=4.0×10-38.滤液的pH至少为
(3)A溶液中主要含有的溶质是
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌.取碱式碳酸锌6.82g,溶于HCl生成CO2 448mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式
考点:制备实验方案的设计
专题:实验设计题
分析:含锌物料(含FeO、CuO等杂质)加硫酸溶解,生成硫酸锌、硫酸铜、硫酸亚铁混合溶液,加双氧水把亚铁离子转化为铁离子,调节PH铁离子转化为氢氧化铁沉淀,过滤,在滤液中加锌粉还原铜离子为Cu,过滤,滤液为硫酸锌溶液,在滤液中加碳酸氢铵,生成碳酸锌沉淀,过滤,滤渣为碳酸锌固体,溶液为硫酸铵溶液,焙烧碳酸锌分解生成ZnO和二氧化碳;
(1)根据=
计算;
(2)①粗略测定溶液pH的用pH试纸测定;
②依据沉淀溶解平衡中的溶度积计算氢氧根离子浓度,结合溶液的离子积常数计算得到氢离子浓度计算溶液pH;
(3)依据流程分析可知,碳酸氢铵洗涤沉淀表面硫酸反应生成硫酸铵,所以A中主要含有的溶质是(NH4)2SO4;铵根离子与氢氧根离子在反应生成氨气和水,氨气与湿润的红色石蕊试纸变蓝;
(4)依据元素守恒关系分别计算各微粒物质的量,其中物质组成的离子关系,反应的定量关系,质量关系计算得到判断出的各成分物质的量取最简整数比得到化学式.
(1)根据=
| 1000ρw |
| M |
(2)①粗略测定溶液pH的用pH试纸测定;
②依据沉淀溶解平衡中的溶度积计算氢氧根离子浓度,结合溶液的离子积常数计算得到氢离子浓度计算溶液pH;
(3)依据流程分析可知,碳酸氢铵洗涤沉淀表面硫酸反应生成硫酸铵,所以A中主要含有的溶质是(NH4)2SO4;铵根离子与氢氧根离子在反应生成氨气和水,氨气与湿润的红色石蕊试纸变蓝;
(4)依据元素守恒关系分别计算各微粒物质的量,其中物质组成的离子关系,反应的定量关系,质量关系计算得到判断出的各成分物质的量取最简整数比得到化学式.
解答:
解:(1)稀硫酸的物质的量浓度=
=
=9.18mol/L,
故答案为:9.18mol/L;
(2)①粗略测定溶液pH的用pH试纸测定,操作为:用玻璃棒蘸取待测溶液并滴在pH试纸上,将显示的颜色与标准比色卡对照;
故答案为:用玻璃棒蘸取待测溶液并滴在pH试纸上,将显示的颜色与标准比色卡对照;
②已知:常温下Fe(OH)3的Ksp=4.0×10-38.上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04mol/L,控制滤液的pH,加入H2O2后产生大量红褐色沉淀;
当出现氢氧化铁沉淀时,溶液中Ksp=c3(OH-)c(Fe3+)=4.0×10-38 c(OH-)=1×10-12mol/L,c(H+)=10-2mol/L,pH=2;
故答案为:2;取少量A溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝;
(3)依据流程分析,碳酸氢铵洗涤沉淀表面硫酸反应生成硫酸铵,所以A中主要含有的溶质是(NH4)2SO4,铵根离子与氢氧根离子在反应生成氨气和水,氨气与湿润的红色石蕊试纸变蓝,则检验铵根离子的操作为:取少量A溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝;
故答案为:(NH4)2SO4;取少量A溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝;
(4)n(CO32-)=n(CO2)=0.02 mol;
n(Zn2+)=n(ZnCl2)=
n(Cl-)=
n(HCl)=0.06 mol;
n(OH-)=2n(Zn2+)-2n(CO32-)=0.08 mol;
n(H2O)=[6.82 g-m(Zn2+)-m(OH-)-m(CO32-)]÷18 g/mol=0.02 mol;
n(Zn2+):n(OH-):n(CO32-):n(H2O)=0.06:0.08:0.02:0.02=3:4:1:1:
化学式为:Zn3(OH)4CO3?H2O;
故答案为:Zn3(OH)4CO3?H2O.
| 1000ρw |
| M |
| 1000×1.5×60% |
| 98 |
故答案为:9.18mol/L;
(2)①粗略测定溶液pH的用pH试纸测定,操作为:用玻璃棒蘸取待测溶液并滴在pH试纸上,将显示的颜色与标准比色卡对照;
故答案为:用玻璃棒蘸取待测溶液并滴在pH试纸上,将显示的颜色与标准比色卡对照;
②已知:常温下Fe(OH)3的Ksp=4.0×10-38.上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04mol/L,控制滤液的pH,加入H2O2后产生大量红褐色沉淀;
当出现氢氧化铁沉淀时,溶液中Ksp=c3(OH-)c(Fe3+)=4.0×10-38 c(OH-)=1×10-12mol/L,c(H+)=10-2mol/L,pH=2;
故答案为:2;取少量A溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝;
(3)依据流程分析,碳酸氢铵洗涤沉淀表面硫酸反应生成硫酸铵,所以A中主要含有的溶质是(NH4)2SO4,铵根离子与氢氧根离子在反应生成氨气和水,氨气与湿润的红色石蕊试纸变蓝,则检验铵根离子的操作为:取少量A溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝;
故答案为:(NH4)2SO4;取少量A溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝;
(4)n(CO32-)=n(CO2)=0.02 mol;
n(Zn2+)=n(ZnCl2)=
| 1 |
| 2 |
| 1 |
| 2 |
n(OH-)=2n(Zn2+)-2n(CO32-)=0.08 mol;
n(H2O)=[6.82 g-m(Zn2+)-m(OH-)-m(CO32-)]÷18 g/mol=0.02 mol;
n(Zn2+):n(OH-):n(CO32-):n(H2O)=0.06:0.08:0.02:0.02=3:4:1:1:
化学式为:Zn3(OH)4CO3?H2O;
故答案为:Zn3(OH)4CO3?H2O.
点评:本题考查了物质的制备流程,涉及制备流程的分析、物质的量浓度的计算、离子的检验、溶度积常数的有关计算、化学式的确定等知识点,会根据元素守恒及化合物中化合价的代数和为0确定化学式,难度较大,侧重于考查学生的实验能力和对基础知识的综合应用能力.

练习册系列答案
相关题目
有关物质的使用不涉及化学变化的是 ( )
| A、明矾用作净水剂 |
| B、液氨用作致冷剂 |
| C、漂粉精作消毒剂 |
| D、生石灰作干燥剂 |
将铁片放入下列溶液中,能发生氧化还原反应但不是置换反应的溶液是( )
| A、稀H2SO4 |
| B、CuSO4 |
| C、NaNO3 |
| D、FeCl3 |
现有Mg、Al混合物粉末10.2克,将它溶解在500ml 4mol/L的盐酸中,若要使沉淀量达到最大值,则需要加入2mol/L NaOH溶液体积是( )
| A、500ml |
| B、1000ml |
| C、2000ml |
| D、不能确定 |
下列实验操作中,主要不是从安全因素考虑的是( )
| A、用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜 |
| B、给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热 |
| C、给试管里的液体加热时,试管口应略向上倾斜(约45°角),外壁干燥后再预热 |
| D、酒精灯在不使用时,必须盖上灯帽 |






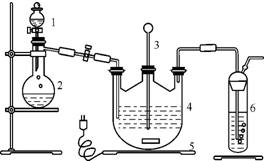 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S