题目内容
3.在下列各溶液中,一定能大量共存的离子组是( )| A. | 常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3- | |
| C. | 含有大量HCO3-的澄清透明溶液中:K+、Al3+、SO42-、Na+ | |
| D. | 常温下c(OH-)/c(H+)=1014的溶液中:K+、Ba2+、Cl-、Br- |
分析 A.常温下水电离的c(H+)为1×10-12mol/L的溶液,为酸或碱溶液;
B.滴加石蕊后呈蓝色的溶液,显碱性;
C.离子之间相互促进水解;
D.常温下c(OH-)/c(H+)=1014的溶液,显碱性.
解答 解:A.常温下水电离的c(H+)为1×10-12mol/L的溶液,为酸或碱溶液,酸溶液中Fe2+、NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,故A不选;
B.滴加石蕊后呈蓝色的溶液,显碱性,不能大量存在HCO3-,且AlO2-促进HCO3-的电离,不能共存,故B不选;
C.Al3+、HCO3-相互促进水解,不能共存,故C不选;
D.常温下c(OH-)/c(H+)=1014的溶液,显碱性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
13.在101kPa、25℃时,1.0g乙烷气体完全燃烧生成液态水时,放出热量52.0kJ,则乙烷燃烧的热化学方程式为( )
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 | |
| D. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 |
14.下列说法正确的是( )
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 标准状况下,22.4 L CCl4和CH2O的混合物中含有6.02×1023个碳原子 | |
| C. | 0.1 mol•L-1 CH3COOH溶液加水稀释,溶液中的离子浓度均减小 | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中醋酸根离子浓度减小 |
11.下列关于电解质的叙述中,不正确的是( )
| A. | 不只是酸、碱、盐类物质才属于电解质 | |
| B. | 氯化钠溶液在电流作用下电离为钠离子与氯离子 | |
| C. | 电解质未必能导电,能导电的也未必是电解质 | |
| D. | 硫酸钡的水溶液虽导电性极弱,但硫酸钡是强电解质 |
18.下列各组物质中,能够满足表中图(该图箭头表示一步能完成的反成)所小转化 关系的是( )
| X | Y | Z | 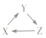 | |
| A | Si | SiO2 | Na2SiO3 | |
| B | HNO3 | NO | NO2 | |
| C | Fe | FeCl3 | Fe(OH)3 | |
| D | Na2O | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
15.在无色透明的溶液中,能大量共存的离子组是( )
| A. | K+、Cu2+、SO42-、Cl- | B. | Na+、H+、Cl-、CO32- | ||
| C. | H+、Ba2+、Cl-、NO3- | D. | K+、Fe2+、OH-、NO3- |
12.下列解释事实的方程式正确的是( )
| A. | 向稀HNO3中加入铜粉产生气体:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向H2SO4溶液中加入Ba(OH)2产生沉淀:SO42-+Ba2+═BaSO4↓ | |
| C. | 向Ca(ClO)2溶液中通入过量CO2制取HClO:2ClO-+H2O+CO2═HClO+CO32- | |
| D. | 向水中加入金属钠产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
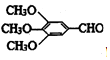 )和抗癫痫药物H(
)和抗癫痫药物H(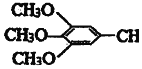 =CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):
=CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):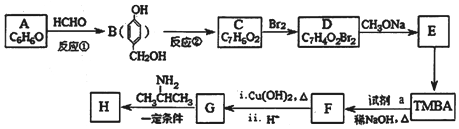
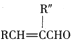 (R、R″表示烃基或氢)
(R、R″表示烃基或氢)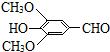 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O.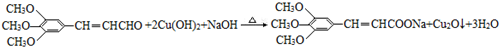 .
.


