题目内容
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ?mol-1,则氢气的燃烧热为241.8kJ?mol-1 |
| B、已知C(石墨,s)=C(金刚石,s)△H=+1.9kJ?mol-1,则金刚石比石墨稳定 |
| C、含0.5mol NaOH的稀溶液与稀醋酸完全中和,放出26.7kJ的热量,则表示该反应中和热的热化学方程式为:OH-(aq)+H+(aq)=H2O(l)△H=-53.4kJ?mol-1 |
| D、已知2H2S(g)+O2(g)=2S(g)+2H2O(l)△H1;2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H2,则△H1>△H2 |
考点:热化学方程式,反应热的大小比较
专题:
分析:A、燃烧热是指氢气燃烧生成液态水时放出的热量;
B、能量越低越稳定;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时所放出的热量;
D、反应1是H2S的不完全燃烧,反应2是H2S的完全燃烧.
B、能量越低越稳定;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时所放出的热量;
D、反应1是H2S的不完全燃烧,反应2是H2S的完全燃烧.
解答:
解:A、氢气的燃烧热是指生成液态水时放出的热量,故A错误;
B、石墨生成金刚石吸热,石墨能量低比较稳定,故B错误;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,而醋酸是弱酸,在离子方程式中不能拆为氢离子,故C错误;
D、反应1是H2S的不完全燃烧,反应2是H2S的完全燃烧,故反应1放出的热量大于反应2放出的热量,而燃烧均为放热反应,故△H均为负值,故△H1>△H2,故D正确.
故选D.
B、石墨生成金刚石吸热,石墨能量低比较稳定,故B错误;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,而醋酸是弱酸,在离子方程式中不能拆为氢离子,故C错误;
D、反应1是H2S的不完全燃烧,反应2是H2S的完全燃烧,故反应1放出的热量大于反应2放出的热量,而燃烧均为放热反应,故△H均为负值,故△H1>△H2,故D正确.
故选D.
点评:本题考查了燃烧热、中和热的概念和反应热的大小比较,应注意的是比较反应热的大小时要带着正负号比较.

练习册系列答案
相关题目
下列离子在有关溶液中能大量共存的是( )
| A、无色溶液:Al3+、K+、Cl-、S2- |
| B、滴加酚酞显红色的溶液:Na+、ClO-、NO3-、Cl- |
| C、滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- |
| D、c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
某同学实际配制的NaOH溶液的浓度偏低,其原因不正确的是( )
| A、使用滤纸称量NaOH固体 |
| B、容量瓶中原来存在少量蒸馏水 |
| C、溶解后的烧杯未经洗涤 |
| D、定容时仰视刻度线 |
配制一定物质的量浓度溶液时,下列操作会使配得溶液物质的量浓度偏高的是( )
| A、没有洗涤烧杯和玻璃棒 |
| B、定容时凹液面最低点低于刻度线 |
| C、容量瓶用蒸馏水洗涤干净后没有进行干燥就移入所配制溶液 |
| D、转移过程中有少量溶液溅出 |
在一定温度下,在一个密闭容器中加入H2和I2蒸气各0.5mol,发生反应H2+I2?2HI,达到平衡时,生成HI 0.8mol,若其它条件不变,开始充入的H2为2mol,则达到平衡时生成的HI可能是下列中的( )
| A、1.1 mol |
| B、0.87 mol |
| C、0.8 mol |
| D、0.5 mol |
下列物质的水溶液能够导电,但属于非电解质的是( )
| A、四氯化碳 | B、二氧化硫 |
| C、氯化氢 | D、氯气 |
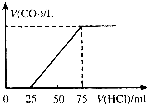 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
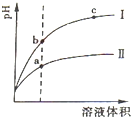 常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH
常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH