题目内容
可逆反应①X(g)+2Y(g)?2Z(g)、②2M(g)?N(g)+p(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板.反应开始和达到平衡状态是有关物理量的变化如图所示:
下列判断正确的是( )

下列判断正确的是( )
| A、反应①的正反应是吸热反应 | ||
| B、在平衡(I)和平衡(II)中的气体摩尔体积相同 | ||
C、达平衡(I)是X的体积分数为
| ||
| D、达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A、从降温导致平衡(Ⅰ)向平衡(Ⅱ)移动时,X、Y、Z的总物质的量变化导致反应移动的方向来判断反应是吸热还是放热;
B.由于温度变化反应②的平衡已经被破坏,气体摩尔体积不会相等的;
C.相同压强下,根据物质的量之比等于体积之比,计算达平衡(I)是X的体积分数;
D.根据等温时,反应②中气体的物质的量不变,压强与体积成反比,并且左右两个容器中的压强关系可判断.
B.由于温度变化反应②的平衡已经被破坏,气体摩尔体积不会相等的;
C.相同压强下,根据物质的量之比等于体积之比,计算达平衡(I)是X的体积分数;
D.根据等温时,反应②中气体的物质的量不变,压强与体积成反比,并且左右两个容器中的压强关系可判断.
解答:
解:A.降温由平衡(Ⅰ)向平衡(Ⅱ)移动,同时X、Y、Z的总物质的量减少,说明平衡向右移动,正反应放热,故A错误;
B.由平衡(Ⅰ)到平衡(Ⅱ),化学反应②发生移动,气体摩尔体积不会相等的,故B错误;
C.达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,则有
=
,x=
=
mol,即物质的量减少了3-
=
mol,据方程式可知:X反应了
mol,所以达平衡(Ⅰ)时,X物质的量为:1mol-=
mol=
mol,X的体积分数为:
÷
=
,故C错误;
D.平衡时,右边物质的量不变,由图可以看出达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为:
=
,故D正确;
故选D.
B.由平衡(Ⅰ)到平衡(Ⅱ),化学反应②发生移动,气体摩尔体积不会相等的,故B错误;
C.达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,则有
| 2 |
| x |
| 2.2 |
| 2.8 |
| 2×2.8 |
| 2.2 |
| 28 |
| 11 |
| 28 |
| 11 |
| 5 |
| 11 |
| 5 |
| 11 |
| 5 |
| 11 |
| 6 |
| 11 |
| 6 |
| 11 |
| 28 |
| 11 |
| 3 |
| 14 |
D.平衡时,右边物质的量不变,由图可以看出达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为:
| 2 |
| 2.2 |
| 10 |
| 11 |
故选D.
点评:本题考查化学平衡移动问题,具有一定难度,做题注意从右边反应体系中的物质的量不变考虑.

练习册系列答案
相关题目
将两个铂电极插入500mL CuSO4溶液中进行电解,通电一段时间后,某一电极增重0.032g(电解时无氢气放出,不考虑水解和溶液体积变化),此时溶液中H+的浓度约为( )
| A、4×10-3mol?L-1 |
| B、2×10-3mol?L-1 |
| C、1×10-3mol?L-1 |
| D、1×10-7mol?L-1 |
12.8g Cu投入100mL 10mol/L的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标况下气体4.48L.将盛有此气体的容器倒扣在水槽中,通入标况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
| A、2.24L |
| B、3.36L |
| C、1.68L |
| D、5.04L |
自来水一般用氯气消毒,因此自来水中含有氯离子.下面是某同学设计的检验自来水中氯离子的方法,其中可靠的是( )
| A、尝一尝自来水有没有咸味 |
| B、先加稀HCl,后加入AgNO3溶液,看有无白色沉淀 |
| C、加入AgNO3溶液,再加入足量稀HNO3,看有无白色沉淀 |
| D、直接加入AgNO3溶液,看有无白色沉淀 |
下列实验操作合理或能达到实验目的是( )
| A、用激光笔检验某KI溶液中是否溶有淀粉 |
| B、配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
| C、向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp(AgI) |
| D、配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
100℃时,两种气态烃以任意比混合,1L混合烃与9L O2混合,充分燃烧后恢复到原状态,所得气体体积仍为10L.下列各组混合烃不符合此条件的是( )
| A、CH4和C2H4 |
| B、CH4和C3H4 |
| C、C2H2和C3H6 |
| D、C2H4和C3H4 |




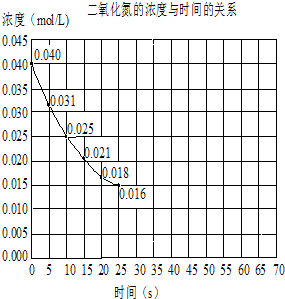 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.