题目内容
6.下列有关化学用语表示正确的是( )| A. | CSO的电子式: | |
| B. | Cl-的结构示意图: | |
| C. | 甲烷分子的比例模型: | |
| D. | 原子核内有20个中子的氯原子:2017Cl |
分析 A、CSO分子中含有一个碳氧双键和1个碳硫双键,各原子最外层都达到8电子稳定结构;
B、氯离子的核内有17个质子;
C、比例模型体现的是组成该分子的原子间的大小以及分子的空间结构,且碳原子半径大于氢原子;
D、质量数等于质子数+中子数.
解答 解:A、CSO为共价化合物,碳原子分别与氧原子和硫原子生成了两对共用电子对,其电子式为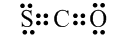 ,故A错误;
,故A错误;
B、氯离子的核内有17个质子,核外有18个电子,故结构示意图为 ,故B错误;
,故B错误;
C、甲烷为正四面体结构,碳原子半径大于氢离子,甲烷分子的比例模型为 ,故C正确;
,故C正确;
D、质量数=质子数+中子数,故原子核内有20个中子的氯原子的质量数为37,故为3717Cl,故D错误.
故选C.
点评 本题考查了常见的化学用语,难度不大,应注意有机物的比例模型和球棍模型的区别.

练习册系列答案
相关题目
17.在中和热测定实验中,应使用的仪器正确的组合是( )
①天平 ②量筒 ③烧杯 ④冷凝管 ⑤温度计 ⑥试管 ⑦酒精灯.
①天平 ②量筒 ③烧杯 ④冷凝管 ⑤温度计 ⑥试管 ⑦酒精灯.
| A. | ①②④⑤ | B. | ②③⑤ | C. | ②③④⑦ | D. | 全部 |
11.下列说法中不正确的是( )
| A. | 甲硫醇(CH3SH)比甲醇(CH3OH)的熔点低的原因是甲醇分子间易形成氢键 | |
| B. | N-O键的极性比C-O键的极性小 | |
| C. | 氨易液化与氨分子间存在氢键有关 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
18.分类是化学学习与研究的常用方法,下列说法正确的是( )
| A. | 某物质水溶的导电能力强,该物质一定是强电解质 | |
| B. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| C. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| D. | 氢氧化铁胶体电泳时阴极颜色加深,证明氢氧化铁胶体带正电 |
16.有如图反应:mA(g)?nB(g),当加压后,反应速率如图所示,推断系数m和n的关系是( )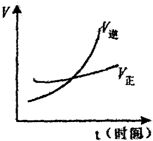

| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |


 ,C→D的反应类型为取代反应.
,C→D的反应类型为取代反应. 或
或 .
. 、
、 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用). 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题.