题目内容
写出下列物质在水溶液中的电离方程式:
HCl: ;
H2SO4: ;
Ca(OH)2: ;
KOH: ;
NH4NO3: ;
KAl(SO4)2: .
HCl:
H2SO4:
Ca(OH)2:
KOH:
NH4NO3:
KAl(SO4)2:
考点:电离方程式的书写
专题:
分析:分清电解质的强弱,常见的强电解质包括:强酸、强碱、大部盐、活泼金属氧化物等,强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答.
解答:
解:HCl为强电解质,电离生成氢离子和氯离子,电离方程式为HCl=Cl-+H+;
硫酸是强电解质,电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-;
Ca(OH)2为强电解质,电离方程式为:Ca(OH)2═Ca2++2OH-;
氢氧化钾是强碱,为强电解质,完全电离,电离方程式为:KOH=K++OH-;
NH4NO3是强电解质水溶液中完全电离,NH4NO3=NH4++NO3-;
KAl(SO4)2在水溶液中完全电离,电离方程式为;KAl(SO4)2=K++Al3++2SO42-,
故答案为:HCl=Cl-+H+;H2SO4═2H++SO42-;Ca(OH)2═Ca2++2OH-;KOH=K++OH-;NH4NO3=NH4++NO3-;KAl(SO4)2=K++Al3++2SO42-.
硫酸是强电解质,电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-;
Ca(OH)2为强电解质,电离方程式为:Ca(OH)2═Ca2++2OH-;
氢氧化钾是强碱,为强电解质,完全电离,电离方程式为:KOH=K++OH-;
NH4NO3是强电解质水溶液中完全电离,NH4NO3=NH4++NO3-;
KAl(SO4)2在水溶液中完全电离,电离方程式为;KAl(SO4)2=K++Al3++2SO42-,
故答案为:HCl=Cl-+H+;H2SO4═2H++SO42-;Ca(OH)2═Ca2++2OH-;KOH=K++OH-;NH4NO3=NH4++NO3-;KAl(SO4)2=K++Al3++2SO42-.
点评:本题考查电离方程式的书写,注意原子团的书写及电离方程式应遵循电荷守恒、质量守恒定律,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列对于Fe(OH)3胶体的说法正确的是( )
| A、当光束通过Fe(OH)3胶体时会产生丁达尔效应 |
| B、由于Fe(OH)3胶体能够吸附氢离子带正电,因此在外加电场的作用下会发生电泳现象 |
| C、Fe(OH)3胶粒做布朗运动是其能够稳定存在的唯一原因 |
| D、向Fe(OH)3胶体中加入稀硫酸出现的现象是体系颜色立即由红褐色变为黄绿色 |
下列化学用语中,书写或说法正确的是( )
| A、乙烯的结构简式:CH2CH2 |
| B、乙醇含有的官能团是-OH,带一个单位负电荷 |
C、丙烷的球棍模型为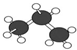 |
| D、乙酸的分子式:C2H4O |
设NA表示阿伏伽德罗常数的值,下列叙述不正确的是( )
| A、标况下,48g O3体积为22.4L |
| B、50ml 0.2mol/L的CuCl2溶液中,Cl-的数目为0.02NA |
| C、11.2LNH3 含分子数为0.5NA |
| D、2.4g金属镁变为镁离子时失去的电子数为0.2 NA |
标准状况下,某气体A的密度是氢气密度的22倍,则下列说法正确的是(已知NA表示阿伏加德罗常数的数值)( )
| A、该气体的相对分子质量是44 |
| B、该气体的体积是22.4L |
| C、该气体的质量是44G |
| D、该气体的原子数是3NA |
表示下列反应的离子方程式正确的是( )
| A、锌和稀硫酸反应:Zn+H+=Zn2++H2↑ |
| B、氢氧化镁溶于稀硝酸:Mg(OH)2+2H+=Mg2++2H2O |
| C、稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、碳酸氢钠和烧碱溶液反应:H++OH-=H2O |
下列关于物质的分类说法正确的是( )
| A、CO2、SO2、CO都是酸性氧化物 |
| B、酒精、烧碱、冰醋酸都是电解质 |
| C、雾、稀豆浆、氯化铁溶液都是胶体 |
| D、氨水、空气、漂白粉都是混合物 |
FeCl3溶液和Fe(OH)3胶体具有的共同性质是( )
| A、具有相同的微粒直径 |
| B、都呈红褐色 |
| C、都能透过半透膜 |
| D、都存在布朗运动 |