��Ŀ����
����Ŀ��a.ij�л���A��ѧʽΪCxHyOz��15 gA��ȫȼ������22 gCO2��9 gH2O����ȷ����
��1�����л�������ʽ______________��
��2����A����Է�������Ϊ60�Һ�Na2CO3���������ų���A�ʹ��ܷ���������Ӧ����A�Ľṹ��ʽΪ _______________ ��
��3����A����Է�������Ϊ60�����ӷ���ˮ����ζ��Һ�壬�ܷ���ˮ�ⷴӦ������ṹ��ʽΪ______________��
��4����A���ӽṹ�к���6��̼ԭ�ӣ����ж�Ԫ����ȩ�����ʣ�����ṹ��ʽΪ_______��
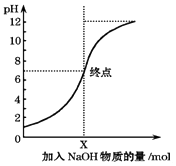
b.�л���A��B��C��D��һ������������ͼ��ʾ��ת����ϵ��

��ش������й����⣺
��1��д��B�ķ���ʽ��____________________��
��2���ֱ�д����Ӧ���ķ�Ӧ����ʽ______________�����ķ�Ӧ����ʽ________________________
��3�����ķ�Ӧ����Ϊ___________________________��
��4��������D��Ũ������ڵ������¼��ȿ��Է���������������Ӧ����E��F����E����Է���������F��С����E��F�Ľṹ��ʽ�ֱ�Ϊ___________________��_________________��
��5�����й����л���A��˵����ȷ����__________________(�����)��
a���������������ӣ����м���
b���ܷ����Ӿ۷�Ӧ
c����ʹ��ˮ��ɫ
d����һ����������������ᷴӦ
���𰸡� CH2O CH3COOH HCOOCH3 ![]() C7H14O2
C7H14O2 
 ������Ӧ
������Ӧ 
 bcd
bcd
��������a�����ݶ�����̼��ˮ��������������غ㶨�ɼ�����ԭ�ӵ�����������ԭ���غ�������ʽ�������л���ķ���ʽ����仯ѧ�����жϽṹ��ʽ��
b��A�����к���̼̼˫���ʹ��ǻ���B�����к��д��ǻ���C�����к��д��ǻ���ȩ����D�����к����Ȼ��ʹ��ǻ�����Ϲ����ŵ����ʡ�ת����ϵ���
a����1��22 gCO2��9 gH2O�����ʵ����ֱ���22g��44g/mol��0.5mol��9g��18g/mol��0.5mol����˸��������غ㶨�ɿ�֪15gA����ԭ�ӵ�������15g��0.5mol��12g/mol��0.5mol��2��1g/mol��8g�����ʵ�����8g��16g/mol��0.5mol�����x��y��z��1��2��1�����Ը��л�������ʽΪCH2O��
��2����A����Է�������Ϊ60������60/30=2�����Է���ʽΪC2H4O2����Na2CO3��Ϸ�Ӧ������ų��������Ȼ���A�����ᣬA�Ľṹ��ʽΪCH3COOH��
��3����A����Է�������Ϊ60������60/30=2�����Է���ʽΪC2H4O2��A���ӷ���ˮ����ζ��Һ�壬�ܷ���ˮ�ⷴӦ��A�Ǽ����������ṹ��ʽΪHCOOCH3��
��4����A���ӽṹ�к���6��̼ԭ�ӣ�����ʽΪC6H12O6�����ж�Ԫ����ȩ�����ʣ���A������������ṹ��ʽΪHOCH2(CHOH)4CHO��
b����1������B�Ľṹ��ʽ��֪B�ķ���ʽΪC7H14O2��
��2����Ӧ���Ǵ��ǻ�����ȥ��Ӧ����Ӧ�ķ���ʽΪ �����Ǵ��ǻ��Ĵ���������Ӧ�ķ���ʽΪ
�����Ǵ��ǻ��Ĵ���������Ӧ�ķ���ʽΪ ��
��
��3����Ӧ����ȩ����������Ӧ��
��4��D�����к����ǻ����Ȼ���2����D���Է���������������Ӧ������E����Է���������F��С����˵���ֱ���ȥ2����ˮ��1����ˮ����E��F�Ľṹ��ʽ�ֱ�Ϊ ��
�� ��
��
��5��a�������ǻ�����������a����b������̼̼˫�����ܷ����Ӿ۷�Ӧ��b��ȷ��c������̼̼˫������ʹ��ˮ��ɫ��c��ȷ��d������ȩ������һ����������������ᷢ��������Ӧ��d��ȷ����ѡbcd��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������(Y)������Ҫ�Ĺ�����ֵ��������ȿ����ѱ��ٿݽߡ�ͨ������������ʯ���Եõ�Y3+�Ľ���Һ��
��1 ����Һ�ɷ�
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
Ũ��/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
��1������Һ�����л��ܼ���HR��������ȡ��ʵ��Y3+�ĸ�������֪��Y3+��Fe3+�������ƣ���ԭ�����£�Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ ����֪��FeR3��YR3��������HR��
YR3 + 3H+ ����֪��FeR3��YR3��������HR��
����Һ�ڲ�ͬpH����ȡ�Ľ����ͼ1��
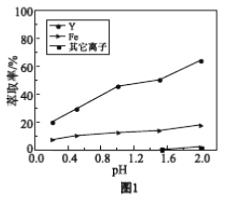
���û�ѧƽ��ԭ�����ͣ���pH����Y3+��ȡ�������ԭ��________��
�ڽ��ͼ1���ͣ���ҵ����ȡY3+֮ǰ��Ӧ���ȳ�ȥFe3+��ԭ����________��
��2���������кͳ��������������ᷨ�����Գ�����
��2 Fe3+��Y3+ȥ����
�յ�pH | ȥ����/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
�кͳ������������Һ�м���NaOH��Fe3+��ȥ�������2��ʾ��
�ٸ�ʵ�������£�Fe3+ȥ���ʱ�Y3+��Ŀ���ԭ��________��
���ᷨ�������ᣨH3PO4����Ԫ���ᣩ���뵽����Һ�У��ټ���Na2CO3��Һ����pHΪ2.5�����˳�ȥ������������FePO4������Һ��ʣ���Fe3+��Y3+Ũ�����3��
��3 ��Һ��Fe3+��Y3+��Ũ��
Fe3+ | Y3+ | |
Ũ��/(mgL-1) | 508 | 68.9 |
�� ��ƽ�����ᷨ�����������е����ӷ���ʽ
Fe3+ + + = FePO4��+ CO2��+ ��___________________
�� �ۺϷ�����1����2����3����ҵ�ϲ��������ᷨ��������ԭ��________��
��3���������ᷨ�����������л��ܼ�HR��ȡY3+����ͨ��________����������ռ���Y3+���л���Һ��
��4���ۺϷ������ϲ��ϣ�����˵����������________��
a. ����ͼ1��֪��pH��0.2��2.0��Χ�ڣ��л��ܼ��е�Fe3+����ˮ��Һ�е�Fe3+
b. ��2�� Y3+��ʧ����20%���ҵ�ԭ����������ɵ�Fe(OH)3��Y3+������
c. ��2�� pH��4.5��5.0��Χ�ڣ�Y3+��ʧ�ʱ��Ŀ���ԭ��Y3+ + 3OH- = Y��OH��3��
d. �л��ܼ���ȡY3+���ŵ���Ca2+��Mg2+��Mn2+�Ƚ���������ȡ�ʼ���