题目内容
4.下列有关金属元素特征的叙述正确的是( )| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素的单质在常温下均为金属晶体 | |
| C. | 金属元素在不同的化合物中的化合价均不同 | |
| D. | 金属元素在一般化合物中只显正价 |
分析 A、金属单质在反应中只能失去电子,亚铁离子既有氧化性又有还原性;
B、金属单质Hg在常温下为液体;
C、绝大数金属元素在不同化合物中化合价相同;
D、金属易失电子.
解答 解:A、金属单质在反应中只能失去电子,但处于中间价态的金属离子既有氧化性又有还原性,如亚铁离子既有氧化性又有还原性,故A错误;
B、因金属单质Hg在常温下为液体,而晶体是固体,故B错误;
C、因绝大数金属元素只有一种正价,则在不同化合物中化合价相同,故C错误;
D、金属易失电子,金属元素在一般化合物中只显正价,故D正确;
故选D.
点评 本题考查金属元素的性质,熟悉常见的金属单质及金属对应的阳离子是解答本题的关键,难度不大.

练习册系列答案
相关题目
14.燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质溶液通常是KOH溶液.下列关于甲烷燃料电池的说法错误的是( )
| A. | 负极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 随着不断放电,电解质溶液碱性不变 | |
| D. | 甲烷燃料电池也可以用稀硫酸做电解质溶液 |
12.具有下列电子层结构的原子或离子,其对应的元素一定属于同一周期的是( )
| A. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| B. | 两原子其核外全部都是s电子 | |
| C. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s22p6的离子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
19.下列关于氦原子电子云图的说法正确的是( )
| A. | 通常用小黑点来表示电子的多少,黑点密度大,电子数目大 | |
| B. | 黑点密度大小,表示单位体积内电子出现的机会多少 | |
| C. | 通常用小黑点来表示电子绕核作高速圆周运动 | |
| D. | 电子云图是对运动无规律性的描述 |
9.1869年,俄国化学家门捷列夫制作了第一张元素周期表,成为化学史上重要的里程碑之一,下列有关元素周期表的说法正确的是( )
| A. | 在元素周期表中,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有18个族 | |
| C. | ⅠA族的元素不全都是金属元素 | |
| D. | 短周期指的是一、二、三、四周期 |
13.T K时,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2 s 的平均速率v(CO)=0.080mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=“0.11“mol•L-1,则反应的△H<0 | |
| C. | T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 | |
| D. | T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% |
 的分子式为:C4H8O.
的分子式为:C4H8O.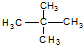 和
和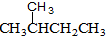 ⑧CH4和CH3CH3
⑧CH4和CH3CH3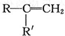 $→_{②酸化}^{①KMnO_{4}/OH-}$
$→_{②酸化}^{①KMnO_{4}/OH-}$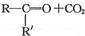 (R、R′可表示烃基或官能团)A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
(R、R′可表示烃基或官能团)A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
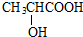 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O,其反应类型是消去反应.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O,其反应类型是消去反应.