题目内容
13.T K时,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达到平衡.反应过程中测定的部分数据见表:| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2 s 的平均速率v(CO)=0.080mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=“0.11“mol•L-1,则反应的△H<0 | |
| C. | T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 | |
| D. | T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% |
分析 A.根据v(Cl2)=$\frac{△c}{△t}$结合反应速率之比等于化学计量数之比计算v(CO);
B.平衡时c(Cl2)=$\frac{0.20mol}{2.0L}$=0.10mol/L,升高温度,平衡时c(Cl2)=0.11 mol•L-1,说明平衡向正反应方向移动;
C.根据平衡时氯气的物质的量计算各物质的平衡浓度,可计算该温度下的平衡常数,以此判断反应进行的方向;
D.向容器中充入1.0molCl2和1.0molCO,应等效于向2.0L恒容密闭容器中充入1.0mol COCl2,从等效平衡的角度分析.
解答 解:A.反应在前2 s的平均速率v(Cl2)=$\frac{△c}{△t}$=$\frac{\frac{0.16mol}{2.0L}}{2s}$=0.04mol•L-1•s-1,则反应在前2 s的平均速率v(CO)=v(Cl2)=0.04mol•L-1•s-1,故A错误;
B.平衡时c(Cl2)=$\frac{0.20mol}{2.0L}$=0.10mol/L,升高温度,平衡时c(Cl2)=0.11 mol•L-1,说明平衡向正反应方向移动,则正反应应为吸热反应,△H>0,故B错误;
C. COCl2(g)?Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
该温度下K=$\frac{0.1×0.1}{0.4}$=0.025,
若起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,此时Qc=$\frac{0.1×0.1}{0.9}$<0.025,则反应应向正反应方向移动,反应达到平衡前v正>v逆,故C正确;
D.T K时起始向容器中充入1.0molCl2和1.0molCO,应等效于向2.0L恒容密闭容器中充入1.0mol COCl2,达到平衡时Cl2的转化率等于80%,如加入1.0 mol Cl2和0.9 mol CO,相当于在原来的基础上减小0.1molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率小于80%,故D正确.
故选CD.
点评 本题综合考查化学平衡的计算以及等效平衡问题,题目难度较大,注意把握平衡常数的意义及应用.

| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素的单质在常温下均为金属晶体 | |
| C. | 金属元素在不同的化合物中的化合价均不同 | |
| D. | 金属元素在一般化合物中只显正价 |
| A. | CH2═CH2+ (过氧乙酸)→ (过氧乙酸)→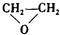 +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Ca(OH)2→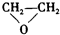 +CaCl2+H2O +CaCl2+H2O | |
| C. | 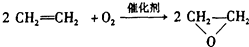 | |
| D. |  |
| A. | 苯酚能与NaOH溶液反应,而己醇不能 | |
| B. | 乙烯可发生加成反应,而乙烷不能 | |
| C. | 苯酚能与浓溴水反应,而苯不可以 | |
| D. | 丙酮(CH3COCH3)分子中的氢原子比乙烷分子中的氢原子更易被卤原子取代 |
| A. | 小于90% | B. | 等于90% | C. | 大于90% | D. | 无法判断 |
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与  互为同分异构体的芳香族化合物有5种 互为同分异构体的芳香族化合物有5种 | |
| C. | 结构简式为 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| D. | 菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
| A. | A和B一定是同分异构体 | B. | A和B不可能是同系物 | ||
| C. | A和B的实验式一定相同 | D. | A和B的化学性质一定相似 |
| A. | CH3CH Cl2 | B. | CH3CH2Cl | C. | CH3CH2OH | D. | CH2ClCH2Cl |