题目内容
7.(1)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系,如右表:
①试比较:K1>K2(填“>”、“=”或“<”)
②400℃时,其逆反应2NH3(g) N2(g)+3H2(g)的化学平衡常数的值为:2
(2)恒温恒容时,在该密闭容器中充入1mol N2与3mol H2 ,达到平衡时生成了1mol NH3 ;
相同条件下,充入amol N2、b mol H2 、1 mol NH3 ,若达到平衡时也生成了1mol NH3 ,
则a=0.5;b=1.5.
(3)恒温恒容时,向(2)中平衡体系中再充入1mol N2,则N2的转化率将减小;H2的转化率将增大.(填“变大”、“变小”或“不变”)
分析 (1)①该反应为放热反应,温度越高,平衡常数越小;
②400℃时反应N2(g)+3H2(g)?2NH3(g)的平衡常数K=0.5,结合平衡常数的表达式判断2NH3(g) N2(g)+3H2(g)的平衡常数;
(2)恒温恒容时,两个平衡达到平衡时生成了相同物质的量的NH3,说明两个平衡为等效平衡,达到平衡时各组分的浓度一定相等;
(3)恒温恒容时充入氮气,氮气的转化率减小,氢气的转化率增大.
解答 解:(1)①反应N2(g)+3H2(g)?2NH3(g)的△H<0,为放热反应,升高温度后平衡向着逆向移动,化学平衡常数减小,则化学平衡常数:K1 >K2,
故答案为:>;
②根据表中数据可知,400℃时N2(g)+3H2(g)?2NH3(g)的平衡常数K=0.5,则2NH3(g) N2(g)+3H2(g)的化学平衡常数K=$\frac{1}{0.5}$=2,
故答案为:2;
(2)恒温恒容时,在该密闭容器中充入1mol N2与3mol H2 ,达到平衡时生成了1mol NH3;相同条件下,充入amol N2、b mol H2 、1 mol NH3 ,若达到平衡时也生成了1mol NH3 ,说明两个平衡为等效平衡,达到平衡时各组分的物质的量一定相等,
根据反应N2(g)+3H2(g)?2NH3(g)可知,生成1mol氨气消耗0.5mol N2、1.5mol H2,则平衡时剩余0.5mol N2、1.5mol H2,所以a=0.5、b=1.5,
故答案为:0.5;1.5;
(3)恒温恒容时,向(2)中平衡体系中再充入1mol N2,平衡向着正向移动,但N2的转化率将减小,H2的转化率将增大,
故答案为:减小;增大.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学平衡常数、化学平衡及其影响、等效平衡等知识,题目难度中等,明确化学平衡常数概念及表达式为解答关键,注意掌握等效平衡的判断及应用方法,试题培养了学生的灵活应用能力.

 智慧小复习系列答案
智慧小复习系列答案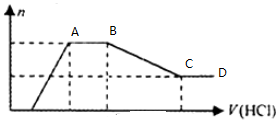
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前 5min 的平均速率为 v (SO2)=0.08mol•L-1•min-1 | |
| B. | 保持温度不变,向平衡后的容器中再充入 1molSO2和 0.5molO2时,v (正)>v (逆) | |
| C. | 该温度,反应的平衡常数为 11.25L•mol-1 | |
| D. | 相同温度下,起始时向容器中充入 1.5mol SO3,达平衡时 SO3的转化率为 40% |
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
(1)2min内Z的反应速率v(Z)=0.05mol•L-1•min-1.
(2)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(3)方程式中m=1,n=4,p=2,q=3.
(4)对于该反应,能增大正反应速率的措施是CD
A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度.
| A. | SO2+2H2S═S+2H2O | B. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | ||
| C. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | D. | 3Cl2+6KOH═5KCl+KClO3+3H2O |
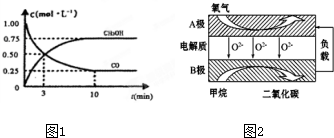
 根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池, (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.