题目内容
15.由铝、硅两种物质组成的试样11g,均匀地分成等质量的两份,一份与足量的盐酸接触可产生气体a L,另一份与足量的NaOH溶液接触产生同样的气体b L,合并两次收集的气体共有11.2L(标准状况).试分析此试样中两种物质的百分含量.分析 铝能够与盐酸和氢氧化钠溶液反应生成氢气,而硅只能与氢氧化钠溶液反应生成氢气,则与盐酸反应生成的气体为铝反应生成的,则Si与氢氧化钠溶液反应生成的气体为为:(b-a)L,然后根据电子守恒计算出铝、硅的物质的量,再计算两种物质的百分含量.
解答 解:一份与足量的盐酸接触可产生气体a L,该气体为Al与HCl反应生成的,2Al+6HCl=2AlCl3+3H2↑,根据电子守恒可得:3n(Al)=$\frac{a}{22.4L/mol}$×2,整理可得:n(Al)=$\frac{2a}{22.4×3}$mol,
一份与足量的NaOH溶液接触产生同样的气体b L,该气体为铝、硅与NaOH反应生成的,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Si+2NaOH+H2O=Na2SiO3+2H2↑
电子守恒分析可知Si与NaOH反应生成的氢气体积为:(b-a)L,根据电子守恒可得:n(Si)=$\frac{b-a}{22.4}$×$\frac{2}{4}$mol=$\frac{b-a}{22.4×2}$mol,
由铝、硅两种物质组成的试样11g,均匀地分成等质量的两份,每份质量为5.5g,
Al的百分含量=$\frac{\frac{2a}{22.4×3}mol×27g/mol}{5.5g}$×100%=$\frac{45a}{308}$×100%,
Si的百分含量=$\frac{\frac{b-a}{22,4×2}mol×28g/mol}{5.5g}$×100%=$\frac{5(b-a)}{44}$×100%,
答:此试样中两种物质的百分含量,Al的百分含量$\frac{45a}{308}$×100%,Si的百分含量$\frac{5(b-a)}{44}$×100%.
点评 本题考查了混合物反应的计算,题目难度中等,明确铝、硅的化学性质及反应的反应原理为解答关键,试题培养了学生的分析、理解能力及化学计算能力.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 形成均匀的无色溶液 | B. | 形成均匀的紫红色溶液 | ||
| C. | 液体分层,上下层均呈无色 | D. | 液体分层,下层呈紫红色 |
| A. | 溶液中c(NH4+)离子浓度 | B. | 氨水的电离程度 | ||
| C. | 水的离子积常数 | D. | c(H+)/c(NH3•H2O) |
| A. | CH3Cl只代表一种物质 | B. | CH2Cl2只代表一种物质 | ||
| C. | CHCl3只代表一种物质 | D. | CCl4和CH4的结构相同 |
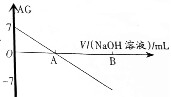 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-6 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(H+)+c(CH3COOH) |
| A. | 一定不存在乙烯 | B. | 一定不存在甲烷 | C. | 一定存在甲烷 | D. | 一定存在乙烯 |
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增加 ④平衡时反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥可能是使用了催化剂.
| A. | ①②⑤ | B. | ④⑥ | C. | ②⑤ | D. | ③④⑤ |
| A. | K+、Na+、NO3-、Cl- | B. | Na+、NH4+、SO42-、Cl- | ||
| C. | Na+、K+、I-、NO3- | D. | Na+、K+、MnO4-、Br- |