题目内容
11. (1)某蓄电池的反应为NiO2+Fe+2H2O $?_{充电}^{放电}$Fe(OH)2+Ni(OH)2.
(1)某蓄电池的反应为NiO2+Fe+2H2O $?_{充电}^{放电}$Fe(OH)2+Ni(OH)2.①该蓄电池充电时,发生还原反应的物质是Fe(OH)2.
②放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是0.4mol.
(2)空间实验室的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图.
①电极a为阴极,电极c为正极.(填“正”或“负”或“阴”或“阳”)
②写出各电极的电极反应式:
a为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,
b为4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+,
c为O2+4e-+4H+=2H2O,
d为H2-2e-=2H+.
③d极上发生氧化(填“氧化”或“还原”反应),当有0.1mol电子转移时,a极产生1.12L气体(标准状况下)
分析 (1)①充电时阴极上得电子发生还原反应;
②根据氢氧化亚铁和转移电子之间的关系式计算;
(2)依据图示ab电极是电解池的电极,由电源判断a为阴极产生的气体是氢气,b为阳极产生的气体是氧气;cd电极是原电池的正负极,c是正极,d是负极;电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑;a电极为阴极得到电子发生还原反应:4H++4e-=2H2↑;
原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+;c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O,以此解答该题.
解答 解:(1)①充电时,阴极上Fe(OH)2得电子生成Fe而发生还原反应,故答案为:Fe(OH)2;
②转移电子物质的量=$\frac{18g}{90g/mol}$(2-0)=0.4mol,
故答案为:0.4;
(2)依据图示ab电极是电解池的电极,由电源判断a为阴极产生的气体是氢气,b为阳极产生的气体是氧气;cd电极是原电池的正负极,c是正极,d是负极;电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑;a电极为阴极得到电子发生还原反应:4H++4e-=2H2↑;
原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+;c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O,
①电极a为阴极,电极c为正极,故答案为:阴;正;
②a电极反应式:2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,故答案为:2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
b电极反应式:4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+,故答案为:4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+;
c电极反应式:O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
d电极反应式:H2-2e-=2H+,故答案为:H2-2e-=2H+;
③d极上发生氧化反应,当有0.1mol电子转移时,a极产生0.05mol的氢气,体积为:1.12L,故答案为:氧化;1.12.
点评 本题考查了化学电源新型电池,主要考查原电池和电解池的工作原理,电极判断,电极反应,关键是原电池中电解质溶液是酸性环境,注意电极书写.

| A. | 16 | B. | 16 g•mol-1 | C. | 32 | D. | 32 g•mol-1 |
| A. | 家庭中经常用食醋浸泡有水垢的水壶 | |
| B. | 甘油加水作护肤剂 | |
| C. | 交通警察用酸性重铬酸钾检查司机是否酒后驾车 | |
| D. | 烹鱼时,加入少量的料酒和食醋可减少腥味,增加香味 |
| A. | 氧化性:X 2+>W2+>Y 2+>Z 2+ | |
| B. | 氧化性:W2+>X 2+>Z 2+>Y 2+ | |
| C. | 还原性Y>Z>W>X | |
| D. | 能发生氧化还原反应Z 2++X=X 2++Z |
| A. | +2,+2 | B. | +2,+3 | C. | +2,+4 | D. | +3,+3 |
 过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题:
过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题: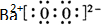 (写电子式),
(写电子式), 2Z(g)ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是( )
2Z(g)ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是( )