题目内容
4.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法中,正确的是( )| A. | 1 mol HCl所具有的总能量高于1 mol H2所具有的总能量 | |
| B. | 1 mol H2和1 mol Cl2所具有的总能量高于2 mol HCl所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
分析 A.该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量;
B.反应物总能量大于生成物总能量为放热反应;
C.根据放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
D.氢气在氯气中燃烧发出苍白色的火焰,放出大量的热.
解答 解:A.该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量,而1 mol HCl与1 mol H2所具有的能量无法比较,故A错误;
B.氢气燃烧为放热反应,反应物总能量大于生成物总能量,则1 mol H2和1 mol Cl2所具有的总能量高于2 mol HCl所具有的总能量,故B正确;
C.反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl为放热反应,断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量,故C错误;
D.氢气在氯气中燃烧发出苍白色的火焰,放出大量的热,该反应中化学能转变为热能和光能,故D错误;
故选:B.
点评 本题主要考查了化学反应的本质以及能量变化原因,明确反应热效应与物质的能量、化学键的变化是解题关键,题目难度不大.

练习册系列答案
相关题目
10.下列离子方程式正确的是( )
| A. | Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 磁性氧化铁溶于稀盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性高锰酸钾溶液和硫酸亚铁溶液反应:MnO4-+3Fe2++4H+═MnO2↓+3Fe3++2H2O |
15.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
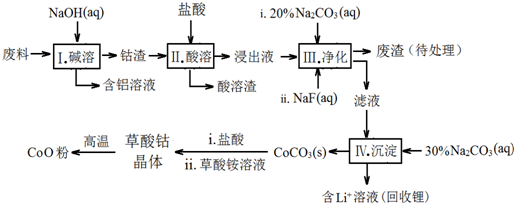
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
19.已知反应A2+B2═2AB,破坏1mol A2中的化学键消耗的能量为Q1 kJ,破坏1mol B2中的化学键消耗的能量为Q2 kJ,形成1mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
| A. | 若A2和B2的总能量之和大于生成的AB的总能量,则反应吸热 | |
| B. | 若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
13.在化学反应中,确认先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
| A. | 含等物质的量的Cu2+、Ag+、H+的溶液中加入铁粉直至过量:Cu2+、Ag+、H+ | |
| B. | 在含Al3+、H+、NH4+的溶液中逐渐加入过量烧碱溶液:H+、NH4+、Al3+ | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2至过量:KOH、Ba(OH)2 | |
| D. | 在含I-、Br-、Fe2+的溶液中通入过量Cl2:I-、Fe2+、Br- |
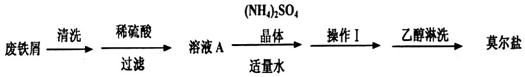
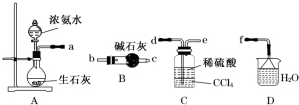
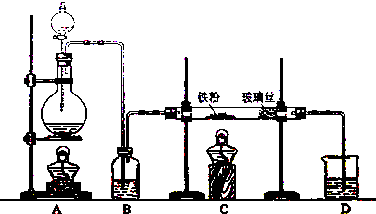
 ).请用化学方程式表示合成过程.
).请用化学方程式表示合成过程.