题目内容
①CaCO3═CaO+CO2;△H=+177.7kJ/mol
②C(s)+H2O(g)═CO(g)+H2(g);△H=-131.3kJ
③0.5H2SO4(l)+NaOH(l)═0.5Na2SO4(l)+H2O(l);△H=+57.3kJ/mol
④C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
⑤CO(g)+
O2(g)═CO2(g);△H=-283kJ/mol
⑥HNO3 (aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l);△H=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有
(2)根据上述信息,写出C转化为CO的热化学方程式 .
(3)上述反应中,表示燃烧热的热化学方程式有 ;表示中和热的热化学方程式有 .
②C(s)+H2O(g)═CO(g)+H2(g);△H=-131.3kJ
③0.5H2SO4(l)+NaOH(l)═0.5Na2SO4(l)+H2O(l);△H=+57.3kJ/mol
④C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
⑤CO(g)+
| 1 |
| 2 |
⑥HNO3 (aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l);△H=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有
(2)根据上述信息,写出C转化为CO的热化学方程式
(3)上述反应中,表示燃烧热的热化学方程式有
考点:燃烧热,中和热
专题:
分析:(1)热化学方程式要标明物质的聚集状态,并且焓变的符号和单位要正确,根据热化学方程式的书写方法来回答;
(2)结合化学反应④⑤,利用盖斯定律来回答;
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热;据此分析判断燃烧热的热化学方程式.
(2)结合化学反应④⑤,利用盖斯定律来回答;
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热;据此分析判断燃烧热的热化学方程式.
解答:
解:(1)根据热化学方程式的书写方法,①②③都是有错误的,错误之处分别是:①中物质没标状态,②是吸热反应,△H=+131.KJ/mol,③除H2O外其它物质的状态不是“l”应为“aq”、△H=-57.3kJ/mol;
故答案为:①②③;
(2)结合化学反应④⑤,利用盖斯定律,反应C(s)+
O2(g)=CO(g)是④-⑤得来,所以焓变△H=-110.5KJ/mol,故答案为:C(s)+
O2(g)=CO(g)△H=-110.5KJ/mol;
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热,上述反应中,④⑤分别是表示C、CO燃烧热的热化学方程式;
稀强酸和稀强碱反应生成1mol水所放出的热量为中和热,上述反应中⑥为中和热的热化学方程式.
故答案为:④⑤;⑥.
故答案为:①②③;
(2)结合化学反应④⑤,利用盖斯定律,反应C(s)+
| 1 |
| 2 |
| 1 |
| 2 |
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热,上述反应中,④⑤分别是表示C、CO燃烧热的热化学方程式;
稀强酸和稀强碱反应生成1mol水所放出的热量为中和热,上述反应中⑥为中和热的热化学方程式.
故答案为:④⑤;⑥.
点评:本题考查学生热化学方程式的书写方法以及盖斯定律计算化学反应的焓变等知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
相关题目
以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉),下列说法错误的是( )
| A、阴极附近溶液呈红色 |
| B、阴极反应式与硫酸钠溶液时相同 |
| C、阳极附近溶液呈蓝色 |
| D、溶液的pH变小 |
下列变化中,不可能通过一步反应实现的是( )
| A、SiO2→Na2SiO3 |
| B、SiO2→H2SiO3 |
| C、CuSO4→CuCl2 |
| D、Cu(OH)2→CuO |
21世纪由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是( )
| A、氢能 | B、天然气 |
| C、潮汐能 | D、生物质能 |
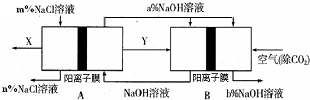 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )
氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )| A、X为H2,Y为Cl2 |
| B、A池为电解池,且m<n |
| C、B池为燃料电池,且a>b |
| D、该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度 |
下列关于热化学反应的描述中不正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=2×283.0 kJ?mol-1 |
| C、需要加热才能发生的反应不一定是吸热反应 |
| D、1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷燃烧热 |
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、氧化剂得电子数与还原剂失电子数之比为1:1 |
| C、NaCl是氧化产物 |
| D、被氧化的氯原子和被还原的氯原子的物质的量之比为1:1 |
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA |
| B、将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L |
| C、在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |