题目内容
3.有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于18,其中X是金属元素,V元素原子的最外层只有一个电子,W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半.由此可推知(填元素符号):VH,WO,XAl,YS.
分析 V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于18,其中X是金属元素,V元素原子的最外层都只有一个电子,则V元素位于第IA族,只有X是金属元素,则V为H元素;
W和Y元素原子的最外层电子数相同,二者位于同一主族,且W元素原子L层电子数是K层电子数的3倍,则W的L层电子数是6,为O元素,则Y是S元素,Z原子序数大于Y且小于18,为Cl元素;
X元素原子的最外层电子数是Y元素原子最外层电子数的一半,且X为金属元素,则X为Al,据此分析解答.
解答 解:V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于18,其中X是金属元素,V元素原子的最外层都只有一个电子,则V元素位于第IA族,只有X是金属元素,则V为H元素;
W和Y元素原子的最外层电子数相同,二者位于同一主族,且W元素原子L层电子数是K层电子数的3倍,则W的L层电子数是6,为O元素,则Y是S元素,Z原子序数大于Y且小于18,为Cl元素;
X元素原子的最外层电子数是Y元素原子最外层电子数的一半,且X为金属元素,则X为Al;
通过以上分析知,V、W、X、Y、Z五种元素分别是H、O、Al、S、Cl元素,故答案为:H;O;Al;S.
点评 本题考查位置结构性质相互关系及应用,为高频考点,侧重考查学生对原子结构、元素周期表结构的认识,明确原子构成、元素周期表结构即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.NA表示阿伏加德罗常数的值,下列关于0.1mol/LK2SO4溶液的说法正确的是( )
| A. | 1000mL水中所含K+、SO42-总数为0.15NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+的浓度为0.1mol/L | |
| D. | 1L溶液中SO42-的浓度是0.2mol/L |
11.下列说法正确的是( )
| A. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | 按系统命名法,化合物 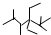 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
18.氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%=35.453中( )
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 35.5表示氯元素的近似相对原子质量 | |
| C. | 24.23%表示35Cl的丰度 | |
| D. | 36.966表示37Cl的质量数 |
12.常温下,将某可溶性一元碱X0H和盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明XOH是强碱还是弱碱a=7为强碱,a<7为弱碱.
(2)考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否(选填“是”或“否”).混合液中离子浓度c(Cl-)与 c(X+)的大小关系是c(Cl-)=c(X+).
(3)丙组实验结果分析,XOH是弱碱(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是
(Cl-)>c(X+)>c(H+)>c(OH-).
(4)若甲组实验中a=5,则该混合溶液中:
c(Cl-)-c(X+)=10-5-10-9mol•L-1; c(H+)-c(XOH)=10-9mol•L-1.
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
(2)考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否(选填“是”或“否”).混合液中离子浓度c(Cl-)与 c(X+)的大小关系是c(Cl-)=c(X+).
(3)丙组实验结果分析,XOH是弱碱(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是
(Cl-)>c(X+)>c(H+)>c(OH-).
(4)若甲组实验中a=5,则该混合溶液中:
c(Cl-)-c(X+)=10-5-10-9mol•L-1; c(H+)-c(XOH)=10-9mol•L-1.