题目内容
4.化学反应原理在生产和科研中有重要的应用,请利用相关知识回答下列问题.Ⅰ.常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图1所示:
(1)该反应的平衡常数表达式K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$;
(2)0~0.5min内的平均反应速率v(CO)=0.8mol/(mol•L);
(3)下列叙述能说明反应达到平衡的是BD
A.容器内压强不再变化
B.CO的质量不再变化,CO2的转化率不再增大
C.CO2的生成速率等于CO的消耗速率,反应物不再转化为生成物
D.混合气体的平均相对分子质量不再改变
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是AC
A.平衡时生成I2的质量为原来的2倍
B.达到平衡的时间为原来的2倍
C.平衡时混合气体的物质的量为原来的2 倍
D.平衡时混合气体的密度不变
Ⅱ.一定条件下在密闭容器中加入NH4I发生反应:A.NH4I(s)?NH3(g)+HI(g),
B.2HI(g)?H2(g)+I2(g).达到平衡后,扩大容器体积,反应B 的移动方向不移动(填正向、逆向或不移动);
Ⅲ.己知:2NO2?N2O4△H<0,将一定量的NO2充入注射器中后封口,如图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是AC
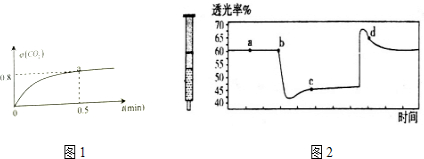
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)>v(逆)
分析 Ⅰ.(1)平衡常数为气体生成物与气体反应物的浓度幂之积的比值;
(2)列三段式求出0~0.5min内反应消耗的CO,再求出其反应速率;
(3)达到平衡时,正逆反应速率相等,各物质的浓度、含量不变;
(4)该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,根据等效平衡的特点分析;
II.2HI(g)?H2(g)+I2(g)反应前后体积不变,改变压强,平衡不移动;
III.该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大.
解答 解:I.(1)平衡常数为气体生成物与气体反应物的浓度幂之积的比值,由于反应物、生成物各一种气体,平衡常数为K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$,
故答案为:$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$;
(2)设0~0.5min内反应消耗的CO为xmol,
5CO(g)+I2O5(g)?5CO2(g)+I2(s)
起始量(mol):1 0
反应量(mol):x x
平衡量(mol):1-x x
则 $\frac{xmol}{1mol}$=0.8,所以x=0.8,则v(CO)=$\frac{\frac{n}{V}}{t}$=$\frac{\frac{0.8mol}{2L}}{5min}$=0.8mol/(mol•L),
故答案为:0.8mol/(mol•L);
(3)A.反应前后气体的体积不变,则容器内压强不再变化不能说明达到平衡状态,故A错误;
B.CO的质量不再变化,CO2的转化率不再增大,可说明达到平衡状态,故B正确;
C.反应没有停止,不存在反应物不再转化为生成物的说法,故C错误;
D.混合气体的平均相对分子质量不再改变,可说明气体的质量不变,可说明达到平衡状态,故D正确.
故答案为:BD;
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,
A.等效平衡的转化率相同,若开始加入CO(g)的物质的量是原来的2倍,则生成I2的质量为原来的2倍,故A正确;
B.浓度增大,反应速率增大,达到平衡的时间减少,故B错误;
C.达到相同的平衡状态,则平衡时混合气体的物质的量为原来的2 倍,故C正确;
D.加入气体增多,气体密度增大,故D错误.
故答案为:AC;
II.反应2HI(g)?H2(g)+I2(g)前后气体物质的量不变,所以增大容器体积,平衡不移动,故答案为:不移动;
III.A.b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;
B.c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C.b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;
D.c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:AC.
点评 本题考查了化学平衡的有关计算、影响平衡的因素,为高考常见题型,题目综合性较强,难度较大,侧重于考查学生对知识的综合应用能力和数据处理能力.

 阅读快车系列答案
阅读快车系列答案| A. | Na、K--遇湿易燃物品 | B. | TNT、NH4NO3--爆炸品 | ||
| C. | CH4、C2H5OH--易燃气体 | D. | 浓H2SO4、浓HNO3--腐蚀品 |
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)重复出现 | |
| D. | 随着元素原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强重复出现 |

| A. | 该混合物一定是K2CO3和NaCl | B. | 该混合物可能是Na2CO3和KCl | ||
| C. | 该混合物可能是Na2SO4和Na2CO3 | D. | 该混合物一定是Na2CO3和NaCl |
| A. | 浓硝酸光照逐渐变黄,说明光照分解生成的有色产物能溶于其中 | |
| B. | 中和滴定时,眼睛应注视滴定管中的液面下降 | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制得Fe(OH)3胶体 | |
| D. | 配制一定物质的量浓度的溶液时,应将刚溶解后的溶液立即转移到容量瓶中 |
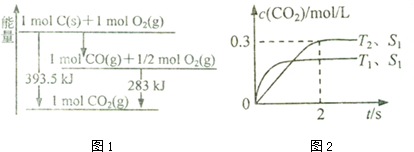
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$
(2)该反应为吸热反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)•c(H2)=c(CO).c(H2O),试判断此时的温度为830℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)?CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为50%,CO的平衡浓为0.5mol/L.
(5)在密闭容器中进行反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1=akJ•mol-1
反应②2CO(g)+O2(g)?2CO2(g)△H2=b kJ•mol-1
反应③2Fe(s)+O2(g)?2FeO(s)△H3
则△H3=(2a+b)kJ/mol(用含a、b的代数式表示).
| A. | 乙醇的结构简式为CH3CH2OH,分子式为C2H5OH | |
| B. | 乙酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 中子数为16的磷原子可表示为${\;}_{15}^{31}$P | |
| D. | S2-结构示意图为 |
| A. | 白色沉淀是BaSO4和BaSO3 | B. | FeCl3全部被还原为FeCl2 | ||
| C. | 白色沉淀是BaSO3 | D. | 溶液的酸性减弱 |