题目内容
有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
| A、Mg和Al |
| B、Mg和Zn |
| C、Fe和Zn |
| D、Cu和Fe |
考点:有关混合物反应的计算
专题:计算题
分析:假设金属与硫酸反应都为+2价,根据电子转移守恒计算金属物质的量,再根据
=
计算金属平均相对原子质量,平均相对原子质量应介于各组分之间,若金属不与稀硫酸反应,由电子转移守恒,其相对原子质量可以视作无穷大.
. |
| M |
| m总 |
| n总 |
解答:
解:标准状况下,11.2L氢气的物质的量为
=0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均相对原子质量为
=26,
A.Mg的相对原子质量为24,若Al为+2价时,其相对原子质量为
×27=18,均小于26,故A错误;
B.Mg的相对原子质量为24,Zn的相对原子质量为65,二者平均相对原子质量介于24~65之间,符合题意,故B正确;
C.Fe的相对原子质量为56,Zn的相对原子质量为65,均大于金属混合物的平均相对原子质量为26,故C错误;
D.Fe的相对原子质量为56,Cu的可看成无穷大,故D错误.
故选B.
| 11.2L |
| 22.4L/mol |
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均相对原子质量为
| 13 |
| 0.5 |
A.Mg的相对原子质量为24,若Al为+2价时,其相对原子质量为
| 2 |
| 3 |
B.Mg的相对原子质量为24,Zn的相对原子质量为65,二者平均相对原子质量介于24~65之间,符合题意,故B正确;
C.Fe的相对原子质量为56,Zn的相对原子质量为65,均大于金属混合物的平均相对原子质量为26,故C错误;
D.Fe的相对原子质量为56,Cu的可看成无穷大,故D错误.
故选B.
点评:本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,本题利用平均值法即可快速解答,注意化合价与相对原子质量的转化,难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列有关工业生产叙述正确的是( )
| A、氯碱工业中通常使用阳离子交换膜将电解池的阳极区与阴极区隔开 | ||||
| B、合成氨工业中,将NH3不断液化分离有利于加快反应速率 | ||||
| C、在铜质餐具上镀银时,应将餐具与电源的正极相连 | ||||
D、高炉炼铁的主要反应为:Fe2O3+3CO
|
下列实验操作及其说法正确的是( )


| A、实验Ⅰ:除去Cl2中混有的HCl气体 |
| B、实验Ⅱ:溶液颜色变红 |
| C、实验Ⅲ:放出大量气体 |
| D、实验Ⅳ:先出现白色沉淀,后溶解 |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入200mL2.20mol/L盐酸中,充分反应后产生896mLH2(标准状况).残留固体1.28g.过滤、滤液中无Cu2+.将滤液加水稀释到500mL,测得其中c(H+)为0.160mol/L.已知Fe+Fe3+=3Fe2+,Cu+2Fe3+=2Fe2++Cu2+.则原混合物中单质铁的质量是( )
| A、2.4g |
| B、3.36g |
| C、5.60g |
| D、10.08g |
下列物质中既能跟氢氧化钠反应又能跟盐酸反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NaHSO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NaHSO3.
| A、③④ | B、②③④⑤ |
| C、①③④ | D、全部 |
将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,不正确的是
( )
( )
A、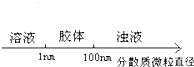 分散系的分类 |
B、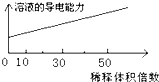 醋酸稀释 |
C、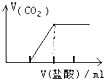 向Na2CO3溶液中逐滴滴入盐酸 |
D、 向AlCl3溶液中滴加过量的NaOH溶液 |


