题目内容
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液。
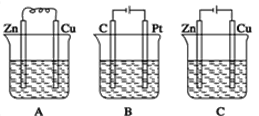
(1)A、B、C三个装置中属于原电池的是___(填标号)。
(2)A池中Zn是___极,电极反应式为___;A中总反应的离子方程式___。
(3)B池中总反应的方程式为___。
(4)C池中Zn是___极,发生___反应,电极反应式为___;反应过程中,CuCl2溶液浓度___(填“变大”“变小”或“不变”)。
【答案】A 负 Zn-2e-=Zn2+ Zn+Cu2+=Zn2++Cu CuCl2![]() Cu+Cl2↑ 阴 还原 Cu2++2e-=Cu 不变
Cu+Cl2↑ 阴 还原 Cu2++2e-=Cu 不变
【解析】
(1)A、B、C三个装置中,没有外接电源的属于原电池。
(2)A池中,相对活泼的金属作负极,电极反应式为金属失电子生成金属离子;A中总反应为负极金属与电解质发生氧化还原反应。
(3)B池中总反应为电解氯化铜。
(4)C池中,与正极相连的电极为阳极,阳极失电子发生氧化反应;通过分析两电极反应,可确定反应过程中,CuCl2溶液浓度变化情况。
(1)A、B、C三个装置中,没有外接电源的属于原电池,则原电池是A。答案为:A;
(2)A池中,相对活泼的金属是Zn,Zn是负极,电极反应式为Zn-2e-=Zn2+;A中总反应的离子方程式为Zn+Cu2+=Zn2++Cu。答案为:负;Zn-2e-=Zn2+;Zn+Cu2+=Zn2++Cu;
(3)B池中总反应,就是电解氯化铜的反应,方程式为CuCl2![]() Cu+Cl2↑。答案为:CuCl2
Cu+Cl2↑。答案为:CuCl2![]() Cu+Cl2↑;
Cu+Cl2↑;
(4)C池中,与负极相连的电极为阴极,Zn与电源负极相连,是阴极,得电子,发生还原反应,电极反应式为Cu2++2e-=Cu;反应过程中,阳极Cu-2e-=Cu2+,生成的Cu2+与阴极消耗的Cu2+物质的量相等,则CuCl2溶液浓度不变。答案为:阴;还原;Cu2++2e-=Cu;不变。