题目内容
改变以下反应的条件,能提高反应物活化分子百分数的是( )
①温度 ②浓度 ③压强 ④正催化剂.
①温度 ②浓度 ③压强 ④正催化剂.
| A、①④ | B、②③ | C、①② | D、③④ |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:升高温度或加入催化剂可提高反应物中的活化分子百分数,以此来解答.
解答:
解:①温度、④正催化剂,均可提高反应物中的活化分子百分数;而压强和浓度只改变活化分子的浓度,不改变百分数,
故选A.
故选A.
点评:本题考查影响活化分子百分数的因素,为高频考点,注意相关知识的积累,明确活化分子数与百分数的区别,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
A、钾(K)原子基态的原子结构示意图为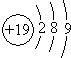 |
B、H2O电子式为 |
C、O的原子基态电子的轨道表示式为 |
| D、Ca2+离子基态电子排布式为1s22s22p63s23p64s2 |
对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g);△H<0;已知m+n>p+q.若反应由A与B组成的混合物开始,并分别在下列情况下达到平衡:在100℃,1×106Pa时,A的转化率为α1;在200℃,1×106Pa时,A的转化率为α2;在100℃,1×107Pa时,A的转化率为α3;则α1,α2,α3之间的大小关系是( )
| A、α1>α2>α3 |
| B、α3>α2>α1 |
| C、α3>α1>α2 |
| D、α1>α3>α2 |
在Na2O2与水反应中,叙述正确的是( )
| A、O2是还原产物 |
| B、NaOH是氧化产物 |
| C、Na2O2是氧化剂,水是还原剂 |
| D、Na2O2中,-1价的氧既得电子,又失电子 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、10g甲烷所含有的电子数目为10NA | ||
| B、1molC2H6分子中共价键总数为7NA | ||
C、标准状况下,a L甲烷和丙烷混合气体中的分子数约为
| ||
| D、标准状况下,22.4L乙醇中含有氧原子数目为NA |
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
| A、压强不变,充入氮气使容器体积增大 |
| B、将容器的体积缩小一半 |
| C、增加铁的量 |
| D、体积不变,充入氮气使容器压强增大 |
柠檬酸的结构简式如图,下列说法正确的是( )
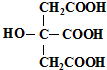
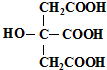
| A、柠檬酸中能发生酯化反应的官能团有2种 |
| B、1 mol柠檬酸可与4 mol NaOH发生中和反应 |
| C、1 mol柠檬酸与足量金属Na反应生成生成1.5mol H2 |
| D、柠檬酸与O2在Cu作催化剂,加热的条件下,能发生氧化反应 |