题目内容
将99mL 0.5mol?L-1H2SO4溶液与101mL 1mol?L-1NaOH溶液充分混合,混合后溶液的pH约为( )
| A、0.4 | B、2 |
| C、12 | D、13.6 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:99mL 0.5mol?L-1H2SO4溶液n(H+)=0.099L×0.5mol/L×2=0.099mol,101mL 1mol?L-1NaOH溶液n(OH-)=0.101L×1mol/L=0.101mol,碱过量,反应后溶液呈碱性,依据KW计算反应后c(H+),可计算pH.
解答:
解:99mL 0.5mol?L-1H2SO4溶液n(H+)=0.099L×0.5mol/L×2=0.099mol,101mL 1mol?L-1NaOH溶液n(OH-)=0.101L×1mol/L=0.101mol,反应后溶液的体积为99mL+101mL=200mL=0.2L,则反应后c(OH-)=
=1×10-2mol?L-1,KW=C(H+)×C(OH-)=1×10-14,C(H+)=
=
mol?L-1=1×10-12mol?L-1,pH=-lgc(H+),pH=12,
故选C.
| 0.101mol-0.099mol |
| 0.2L |
| KW |
| C(OH-) |
| 1×10-14 |
| 1×10-2 |
故选C.
点评:本题考查酸碱混合的计算,答题时注意根据酸碱的浓度判断过量问题,计算出反应后的氢离子或氢氧根离子浓度为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、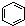 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、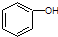 和 和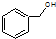 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、乙酸分子中含有碳氧双键,所以它能使溴水褪色 |
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.已知H-H键键能为436kJ?mol-1,N-H键键能为391kJ?mol-1,根据热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.则N≡N键的键能( 单位:kJ?mol-1 )是( )
| A、431 | B、649 |
| C、896 | D、945.6 |
 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A、曲线Ⅱ对应的条件改变是降低压强 |
| B、若曲线I对应的条件改变是升高温度,则该反应△H>0 |
| C、反应开始至a点时v(H2)=1mol?L-1?min-1 |
| D、其它条件不变,若降低该反应的温度,平衡常数值将减小 |
800℃时,焦炭与水蒸气反应生成一氧化碳和氢气,反应热△H=+131.3kJ?mol-1,它表示( )
| A、碳和水反应吸收热量131.3 kJ |
| B、1 mol C(s)和1 mol H2O(g)反应生成一氧化碳和氢气,并吸收131.3 kJ的热量 |
| C、1 mol C跟1 mol H2O反应吸收131.3 kJ的热量 |
| D、固体碳和气态水各1 mol反应,放出131.3 kJ的热量 |
下列选项正确的是( )
 制取氧气 |  制取Fe(OH)2 |  用盐酸滴定NaOH溶液 |  制备乙酸乙酯 |
| A | B | C | D |
| A、A | B、B | C、C | D、D |
用下列装置不能达到有关实验目的是( )
A、 验证HCl的溶解性 |
B、 制备Fe(OH)2 |
C、 干燥并收集NH3 |
D、 利用电解法制H2和Cl2 |