题目内容
在一定温度下,把4mol SO2和2mol O2 通入一定容积的密闭容器里,发生如下反应:2SO2(g)+O2(g)?2SO3(g),进行到一定程度达到平衡状态.现在该容器维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系才能保证达到平衡时,反应混合物中三种气体的质量分数仍跟上述平衡完全相同.
请填写下列空白:
(1)若a=0,b=0,则c= .
(2)a、b、c取值必须满足的一般条件是(请用两个式子表示,其中一个只含a和c,另一个只含b和c): ,
(3)若将上述条件改为恒温、恒压,其他条件均不变,①若a=0,b=0,则c= ;
②a、b、c取值必须满足的一般条件是 .
请填写下列空白:
(1)若a=0,b=0,则c=
(2)a、b、c取值必须满足的一般条件是(请用两个式子表示,其中一个只含a和c,另一个只含b和c):
(3)若将上述条件改为恒温、恒压,其他条件均不变,①若a=0,b=0,则c=
②a、b、c取值必须满足的一般条件是
考点:等效平衡
专题:化学平衡专题
分析:对于平衡状态的建立,只与条件相关,即与温度、压强(或容器的容积)、反应物或生成物的起始量的相对关系有关,而与反应进行的方向无关.
因此对于该条件下的反应,初始态是4mol SO2和2 mol O2的混合物,或是4mol纯净的SO3,两者是等价的,最终到达的平衡状态完全相同.
因此(1)中答案应为c=4.
(2)中要求将具体问题抽象为普遍规律,此时必须把握“把所有初始物都转换为反应物,则必须相当于24mol SO2和2 mol O2的混合物,把所有的初始物转换为生成物,则必须相当于4 mol纯净的SO3”.才能得出正确结论:必须同时满足a+c=4和2b+c=4两个关系式;
(3)若将上述条件改为恒温、恒压,其他条件均不变,则将c转化到左边只要与原来成比例就可以,即
=
即可.
因此对于该条件下的反应,初始态是4mol SO2和2 mol O2的混合物,或是4mol纯净的SO3,两者是等价的,最终到达的平衡状态完全相同.
因此(1)中答案应为c=4.
(2)中要求将具体问题抽象为普遍规律,此时必须把握“把所有初始物都转换为反应物,则必须相当于24mol SO2和2 mol O2的混合物,把所有的初始物转换为生成物,则必须相当于4 mol纯净的SO3”.才能得出正确结论:必须同时满足a+c=4和2b+c=4两个关系式;
(3)若将上述条件改为恒温、恒压,其他条件均不变,则将c转化到左边只要与原来成比例就可以,即
| a+c |
| b+0.5c |
| 4 |
| 2 |
解答:
解:设起始时4molSO2和2molO2为Ⅰ状态,其它条件为Ⅱ状态,温度不变,体积不变时,
根据改变起始加入量情况,则只要通过可逆反应的化学计量数比换算(极限假设转换)成反应方程式左(或右)的同一边物质的物质的量与原平衡相同即可.利用方程式求解:
(1)2SO2+O2 2SO3
2SO3
Ⅰ4mol 2mol 0
Ⅱ0 0 cmol
根据方程式可知:4 mol SO3相当于4mol SO2和2mol O2,故c=4 mol.
故答案为:c=4;
(2)2SO2+O2 2SO3
2SO3
Ⅰ4mol 2mol 0
Ⅱa b c
当SO2和SO3的物质的量之和为4 mol时,才能保证反应初始SO2的物质的量为4mol,即a+c=4mol,此时要求O22mol,那么就有b+0.5c=2mol.
满足此两条件方可使平衡与题说平衡完全相同.故答案为:a+c=4;2b+c=4;
(3)若将上述条件改为恒温、恒压,其他条件均不变,则将c转化到左边只要与原来成比例就可以,即
=
,当①若a=0,b=0,则c=任意值,故答案为:任意值;②a、b、c取值必须满足的一般条件为a=2b;故答案为:a=2b.
根据改变起始加入量情况,则只要通过可逆反应的化学计量数比换算(极限假设转换)成反应方程式左(或右)的同一边物质的物质的量与原平衡相同即可.利用方程式求解:
(1)2SO2+O2
 2SO3
2SO3Ⅰ4mol 2mol 0
Ⅱ0 0 cmol
根据方程式可知:4 mol SO3相当于4mol SO2和2mol O2,故c=4 mol.
故答案为:c=4;
(2)2SO2+O2
 2SO3
2SO3Ⅰ4mol 2mol 0
Ⅱa b c
当SO2和SO3的物质的量之和为4 mol时,才能保证反应初始SO2的物质的量为4mol,即a+c=4mol,此时要求O22mol,那么就有b+0.5c=2mol.
满足此两条件方可使平衡与题说平衡完全相同.故答案为:a+c=4;2b+c=4;
(3)若将上述条件改为恒温、恒压,其他条件均不变,则将c转化到左边只要与原来成比例就可以,即
| a+c |
| b+0.5c |
| 4 |
| 2 |
点评:本题是对可逆反应和化学平衡状态的理解以及利用题给信息将化学问题以及内在规律抽象为数学问题,利用数学工具解决化学问题的思维能力的综合考查.做题时注意在定温(T)、定容(V)条件下,建立的两平衡体系中不仅同种物质的百分含量相等,而且物质的量浓度、物质的量也分别相等而定温(T)、定压(P)条件下,建立的两平衡体系中只要成比例就行.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
实验中需0.2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A、1000mL,21.2g |
| B、950mL,20.14g |
| C、任意规格,21.2g |
| D、500mL,10.6g |
在下列溶液中,能大量共存的离子组是( )
| A、能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- | ||
B、常温下
| ||
| C、含有大量Fe3+的溶液中:SO42-、S2-、AlO2-、ClO- | ||
| D、能使石蕊试液显红色的溶液中:K+、SO42-、CH3COO-、PO43- |
下列溶液中有关物质的量浓度关系不正确的( )
| A、pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、0.1 mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系.
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系.说明:AlO2-即[Al(OH)4]-下列有关叙述正确的是( )
| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:整个阶段Ba2+一定不会等于OH- |
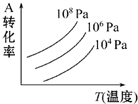 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是转化率与压强、温度的关系.下列叙述正确的是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是转化率与压强、温度的关系.下列叙述正确的是( )| A、正反应是放热反应;m+n<p+q |
| B、正反应是吸热反应;m+n<p+q |
| C、正反应是放热反应;m+n>p+q |
| D、正反应是吸热反应;m+n>p+q |
下列物质能由单质直接化合而成,但不能由单质和盐酸反应生成的是( )
| A、FeCl2 |
| B、CuCl2 |
| C、AlCl3 |
| D、NaCl |
将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示,最先观察到变为红色的区域为( )


| A、Ⅰ和Ⅱ | B、Ⅰ和Ⅳ |
| C、Ⅱ和Ⅲ | D、Ⅱ和Ⅳ |