题目内容
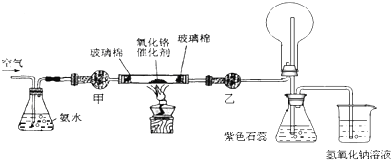
19.A、B、C、D均为中学所学的常见短周期元素组成的物质,且均含有同一种元素,其中A为气态氢化物,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D.(1)若A、D的水溶液均呈酸性,B为无色有刺激性气味的气体,且D为强酸.
①则A、D分别为A:H2S,D:H2SO4.(填写化学式)
②写出B→C转化的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3 .
③简述检验B物质的方法将SO2通入到品红溶液中,溶液褪色,加热后,又恢复为红色.
④写出D的浓溶液和Cu在加热条件的化学方程式2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红.
①则C为NO2(填写化学式).
②写出实验室制取A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
③1.92g铜投入一定量D的浓溶液中,铜完全溶解,共收集到672mL气体(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为336mL.
分析 A、B、C、D均含有同一种元素,其中A为气态氢化物,
(1)若A、D的水溶液均呈酸性,B为无色有刺激性气味的气体,且D为强酸,则S元素化合物符合转化关系,可推知,A为H2S、B为SO2、C为SO3、D为H2SO4;
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,则A为NH3,D的稀溶液能使湿润的蓝色石蕊试纸变红,D呈酸性,则B为NO,C为NO2,D为HNO3.
解答 解:A、B、C、D均含有同一种元素,其中A为气态氢化物,
(1)若A、D的水溶液均呈酸性,B为无色有刺激性气味的气体,且D为强酸,则S元素化合物符合转化关系,可推知,A为H2S、B为SO2、C为SO3、D为H2SO4,
①根据上面的分析可知,A为H2S,D为H2SO4,故答案为:H2S;H2SO4;
②B→C转化的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3 ,故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3 ;
③B为SO2,检验SO2物质的方法是:将SO2通入到品红溶液中,溶液褪色,加热后,又恢复为红色,
故答案为:将SO2通入到品红溶液中,溶液褪色,加热后,又恢复为红色;
④硫酸的浓溶液和Cu在加热条件的化学方程式:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,则A为NH3,D的稀溶液能使湿润的蓝色石蕊试纸变红,D呈酸性,则B为NO,C为NO2,D为HNO3,
①根据上面的分析可知,C为NO2,
故答案为:NO2;
②A为NH3,实验室制取NH3的化学方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
③根据电子得失守恒可知,铜与硝酸浓溶液反应,铜将电子转移给硝酸中的氮,生成氮的氧化物,氮的氧化物又被氧气氧化成了硝酸,所以从电子得失守恒看,铜失去的电子即为氧气所得的电子,所以有关系2Cu~O2,1.92g铜的物质的量为0.03mol,所以氧气的物质的量为0.015mol,则标况下O2的体积为0.015×22.4L=0.336L=336mL,
故答案为:336.
点评 本题考查无机物的推断,为高频考点,把握转化中的连续氧化及两种强酸为推断的关系,侧重N及其化合物、S及其化合物性质的考查,题目难度不大.


| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
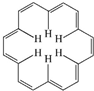 早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )
早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )| A. | [18]-轮烯分子中所有原子不可能处于同一平面 | |
| B. | [18]-轮烯是芳香族化合物 | |
| C. | 1 mol[18]-轮烯最多可与9 mol氢气发生加成反应生成环烷烃 | |
| D. | [18]-轮烯与乙烯互为同系物 |
| 分子式或结构简式 | 满足条件的同分异构体数目 | |
| A | C3H7Cl | 2种 |
| B | C5H12O | 能与金属钠反应的结果有5种 |
| C |  | 一氯代物有2种 |
| D | C5H10O2 | 能与碳酸氢钠溶液反应的结构有4种 |
| A. | A | B. | B | C. | C | D. | D |
| 分子式 | 满足条件 | |
| A | C3H8O | 能与金属钠反应 |
| B | C5H8O4 | 有2个-COOH |
| C | C3H6O2 | 能水解 |
| D | C4H10O | 有3个甲基的醇 |
| A. | A | B. | B | C. | C | D. | D |

下列说法正确的是( )
| A. | 该反应为取代反应 | |
| B. | 维生素C易溶于水,易被氧化 | |
| C. | 1 mol有机物甲最多能和2 mol H2反应 | |
| D. | 两种有机物中含有官能团的种类相同 |
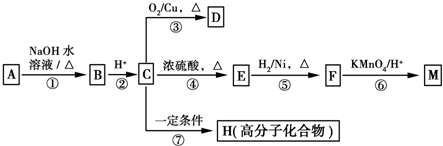
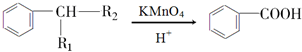 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)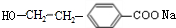 .
.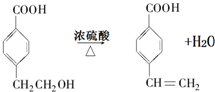 .
. .
.