题目内容
15.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,2.24 L Cl4中含CL原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子书为0.3NA | |
| D. | 常温常压下10g46%酒精溶液中含氧原子总数为 0.3NA |
分析 A、求出氯气的物质的量,然后根据氯气为双原子分子来分析;
B、求出白磷的物质的量,然后根据白磷中含6条P-P键来分析;
C、5.6g铁粉即0.1mol铁粉在2.24 L(标准状况)氯气即0.1mol氯气中燃烧时,氯气完全反应,铁过量;
D、酒精溶液中除了酒精外,水也含氧原子.
解答 解:A、标况下2.24L氯气的物质的量为0.1mol,而氯气为双原子分子,故0.1mol氯气中含0.2NA个氯原子,故A错误;
B、白磷的分子式为P4,故12.4g白磷的物质的量为0.1mol,而白磷中含6条P-P键,故0.1mol白磷中含0.6NA条P-P键,故B正确;
C、5.6g铁粉即0.1mol铁粉在2.24 L(标准状况)氯气即0.1mol氯气中燃烧时,氯气完全反应,铁过量,而氯气反应后变为-1价,故0.1mol氯气得到0.2mol电子,故铁失去0.2mol电子即0.2NA个,故C错误;
D、酒精溶液中除了酒精外,水也含氧原子,故溶液中的氧原子的个数为0.4NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
5.某市对大气进行监测,发现该市首要污染物可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此PM2.5、SO2、NO2等你进行研究具有重要意义.请回答下列问题:
(1)对PM2.5样本用适量蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的PH值=4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作为洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.
若1mol空气含0.8mol N2和0.2mol O2,1300℃时在密闭容器内反应达到平衡.测得NO的物质的量为8×10-4mol,计算该温度下的平衡常数K=4×10-6.汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是该反应为吸热反应,则温度升高,反应速率加快,平衡向吸热方向即右移动.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2N0 $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)对PM2.5样本用适量蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作为洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.
若1mol空气含0.8mol N2和0.2mol O2,1300℃时在密闭容器内反应达到平衡.测得NO的物质的量为8×10-4mol,计算该温度下的平衡常数K=4×10-6.汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是该反应为吸热反应,则温度升高,反应速率加快,平衡向吸热方向即右移动.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2N0 $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
10.下列说法中正确的是(NA为阿伏加德罗常数)( )
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中阳离子总数小于0.1NA |
20.该物质最多有几个碳原子共面( )


| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
4.在一定温度下,向某固定容积的密闭容器中加入1mol N2和3mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g).此反应达到平衡状态的标志是( )
| A. | 容器内气体密度不再发生变化 | |
| B. | 容器内各物质的浓度不再发生变化 | |
| C. | v正(H2)=v逆(NH3) | |
| D. | 单位时间消耗0.1mol N2的同时生成0.2mol NH3 |
5.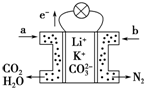 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | a为C4H10,b为CO2 | |
| B. | 在熔融电解质中,CO32-向正极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10-26e-+13CO32-=17CO2↑+5H2O |

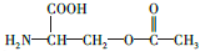 .
. .
.