题目内容
17.已知,CH3COOH和NH3•H2O的电离平衡常数基本相等,则CH3COONH4溶液中c(H+)=c(OH-),水的电离程度与纯水比大,相同浓度的CH3COONH4与CH3COONa溶液比,c(CH3COO-)的大小顺序为CH3COONa>CH3COONH4.分析 醋酸和一水合氨的电离平衡常数相同,则醋酸根离子和铵根离子水解程度相同,据此判断醋酸铵溶液的酸碱性,根据弱电解电离程度及盐类水解的影响因素判断可知,CH3COONH4中铵根离子促进了醋酸根离子的水解,CH3COONa中醋酸根离子少部分水解,醋酸根离子浓度大.
解答 解:醋酸和一水合氨的电离平衡常数相同,则醋酸根离子和铵根离子水解程度相同,所以醋酸铵溶液呈中性,c(H+)=c(OH-),和纯水相比,醋酸铵发生双水解促进水的电离平衡正向进行,所以水的电离程度增大,相同浓度的CH3COONH4与CH3COONa溶液比,c(CH3COO-)醋酸钠溶液中大于醋酸铵溶液中醋酸根离子浓度,CH3COONH4中铵根离子促进了醋酸根离子的水解,CH3COONa中醋酸根离子少部分水解,醋酸根离子浓度大,所以c(CH3COO-)由大到小的顺序是CH3COONa>CH3COONH4,
故答案为:=;大;CH3COONa>CH3COONH4.
点评 本题考查了弱电解质的电离,明确弱电解质电离平衡常数与溶液酸碱性强弱、离子水解能力的关系是解本题关键,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
7.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2.3 g Na变成Na+时,失去的电子数为0.2NA | |
| B. | 0.2NA个H2SO4与19.6 g H3PO4含有相同的氧原子数 | |
| C. | 28 g N2与CO的混合气体,所含的原子数为NA | |
| D. | 含有NA个氧原子的H2SO4的物质的量是4 mol |
12.下列物质中,溶于水后不能电离出Cl-的是( )
| A. | KClO3 | B. | CaCl2 | C. | HCl | D. | AgCl |
2.下列离子方程式中正确的是( )
| A. | 碳酸钠加入醋酸溶液中:CO32-+2H+═H2O+CO2↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | Ba(OH)2加入过量NaHCO3溶液中:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| D. | 铜粉投入FeCl3溶液中:Fe3++Cu═Fe2++Cu2+ |
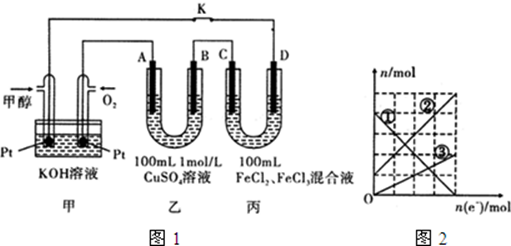
9.某装置如图所示,则下列说法中正确的是( )


| A. | 该装置能够将化学能转化为电能 | B. | 左侧烧杯中没有化学反应发生 | ||
| C. | 该装置中的灯泡会发光 | D. | 左侧烧杯中有气体生成 |
7.下列存放物质的方法中错误的是( )
| A. | Na可保存在CCl4中 | |
| B. | NaOH溶液盛装在带橡皮塞的试剂瓶中 | |
| C. | 用棕色细口试剂瓶存放氯水 | |
| D. | 漂白粉要密闭在容器中保存 |
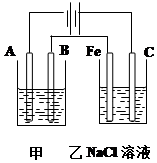 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: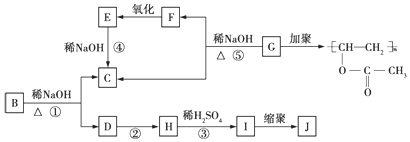
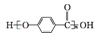 .
.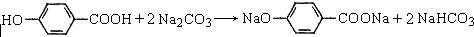 .
.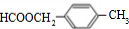 、
、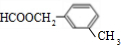 、
、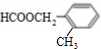 、
、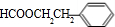 、
、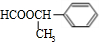 任一种.
任一种.