题目内容
2.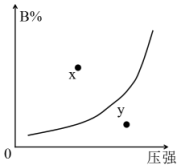 在一定温度下,反应mA(s)+nB(g)?pC(g)△H<0,B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
在一定温度下,反应mA(s)+nB(g)?pC(g)△H<0,B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | x点表示该反应的正反应速率小于逆反应速率 | |
| C. | n<p | |
| D. | x点比y点时的反应速率快 |
分析 由图可知,曲线上的点为平衡点,压强越大,B的体积分数越大,可知增大压强平衡逆向移动,x点在曲线上方,降低B的体积分数可达到平衡,则x点平衡正向移动,以此来解答.
解答 解:A.增大压强平衡逆向移动,则n<P,故A错误;
B.x点平衡正向移动,x点表示该反应的正反应速率大于逆反应速率,故B错误;
C.由选项A可知,n<P,故C正确;
D.y点压强大于x点压强,则x点比y点时的反应速率慢,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,把握图象分析、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
10. 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | Na2SO3溶液 | D. | 饱和NaCl溶液 |
17.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 在101Kpa时,2g H2完全燃烧生成液态水,放出285.8 KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-53.7 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7 kJ |
7.沼气的主体是甲烷.0.5mol CH4完全燃烧为CO2和H2O(l)时,放出445kJ的热量.则甲烷燃烧的热化学方程式是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol | |
| B. | 2 CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+1780kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ/mol | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=-1780kJ/mol |
14.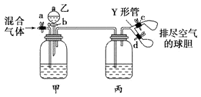 用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )
用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )
 用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )
用如图装置来分离CO2和CO混合气体,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )| 甲 | 乙 | 丙 | |
| A | 饱和NaHCO3溶液 | 12mol•L-1盐酸 | 18.4mol•L-1 H2SO4 |
| B | 饱和Na2CO3溶液 | 2mol•L-1 H2SO4 | 饱和NaOH溶液 |
| C | 饱和NaOH溶液 | 2mol•L-1 H2SO4 | 18.4mol•L-1 H2SO4 |
| D | 18.4mol•L-1 H2SO4 | 饱和NaOH溶液 | 18.4mol•L-1 H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
12.下列对有机化合物的认识正确的是( )
| A. | 油脂不是高分子化合物,能发生水解反应 | |
| B. | 淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体 | |
| C. | 一定条件下, 水解的产物只有 水解的产物只有  | |
| D. | .鸡蛋清溶液在硫酸铜溶液或饱和硫酸铵溶液中均会发生盐析 |
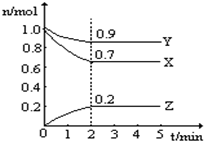 某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: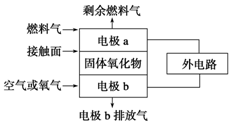 固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动.当燃料气为C2H4时,其正极、负极反应式分别为
固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动.当燃料气为C2H4时,其正极、负极反应式分别为