题目内容
15.NA表示阿伏加德罗常数的值.下列说法中正确的是( )①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100mL 0.1mol•L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA
⑤常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
⑥在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75NA
⑦1.0L 1.0mol•L-1 Na2SiO3水溶液中含有的氧原子数为3NA.
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
分析 ①常温下,氯气和碱的反应为歧化反应;
②求出18gH2O的物质的量,然后根据水中含10个电子来分析;
③一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
④反应KIO3+6HI═KI+3I2+3H2O转移5mol电子,生成3mol碘;
⑤C2H4和C4H8的最简式均为CH2;
⑥0.5molNO与0.5molO2混合后生成的NO2中存在平衡:2NO2?N2O4;
⑦1.0L 1.0mol•L-1 Na2SiO3水溶液中除了硅酸钠外,水也含氧原子.
解答 解:①常温下,氯气和碱的反应为歧化反应,故0.1mol氯气转移0.1NA个电子,故错误;
②18gH2O的物质的量为1mol,而水中含10个电子,故1mol水中含10NA个电子,故正确;
③一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故将100mL 0.1mol•L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA,故错误;
④反应KIO3+6HI═KI+3I2+3H2O转移5mol电子,生成3mol碘,即当3mol I2转移的电子数为5NA,故正确;
⑤C2H4和C4H8的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含原子个数为3NA个,故正确;
⑥0.5molNO与0.5molO2混合后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,则最终分子个数小于0.75NA个,故错误;
⑦1.0L 1.0mol•L-1 Na2SiO3水溶液中除了硅酸钠外,水也含氧原子,故溶液中含有的氧原子的个数多于3NA个,故错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
10.按要求填空.
(1)现有一瓶A和B的混合液,已知它们的性质如表.
据此分析,将A和B相互分离的常用方法是蒸馏.
(2)有下列物质:①铜;②硫酸钡;③NaHCO3固体;④稀硫酸;⑤熔融硝酸钾;⑥乙醇;⑦液态氯化氢;⑧金刚石;⑨二氧化硫;⑩醋酸.其中属于电解质的有②③⑤⑦⑩;写出物质③在水溶液中的电离方程式:NaHCO3═Na++HCO3-
(3)已知反应①2FeCl3+2HI=2FeCl2+2HCl+I2;②H2SO3+I2+H2O=2HI+H2SO4则HI、FeCl2、H2SO3 三种物质的还原性由强到弱的顺序为H2SO3>HI>FeCl2.
(4)一定条件下,XO3n-与I-发生反应的离子方程式为:XO3n-+6I-+6H+═X-+3I2+3H2O,试推断XO3n-中X元素的化合价为+5,n的数值为1.
(1)现有一瓶A和B的混合液,已知它们的性质如表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
(2)有下列物质:①铜;②硫酸钡;③NaHCO3固体;④稀硫酸;⑤熔融硝酸钾;⑥乙醇;⑦液态氯化氢;⑧金刚石;⑨二氧化硫;⑩醋酸.其中属于电解质的有②③⑤⑦⑩;写出物质③在水溶液中的电离方程式:NaHCO3═Na++HCO3-
(3)已知反应①2FeCl3+2HI=2FeCl2+2HCl+I2;②H2SO3+I2+H2O=2HI+H2SO4则HI、FeCl2、H2SO3 三种物质的还原性由强到弱的顺序为H2SO3>HI>FeCl2.
(4)一定条件下,XO3n-与I-发生反应的离子方程式为:XO3n-+6I-+6H+═X-+3I2+3H2O,试推断XO3n-中X元素的化合价为+5,n的数值为1.
20.下列热化学方程式或离子方程式正确的是( )
| A. | 已知H2的燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 稀硫酸和Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ |
6.碳酸钙是一种用途非常广泛的产品,可用于生成硫酸、漂白粉等一系列物质(如图).下列说法正确的
是( )
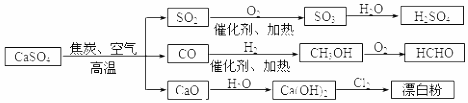
是( )

| A. | CO、SO2均为无色有刺激性气味的有毒气体 | |
| B. | 工业上利用Cl2 和澄清石灰水反应来制取漂白粉 | |
| C. | 除去与水反应,图示转化反应均为氧化还原反应 | |
| D. | 用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
1.对于amolH2O和amolCO2的说法正确的是( )
| A. | 相同条件下体积一定相同 | B. | 氧原子个数一定相同 | ||
| C. | 分子个数一定相同 | D. | 质量比是22:9 |
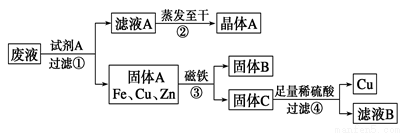
 W+3H2O
W+3H2O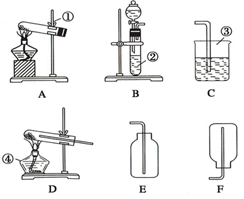 现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)
现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)