题目内容
11.下列离子方程式书写正确的是( )| A. | 铜和稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化铜溶于盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O |
分析 A.不符合反应客观事实;
B.二者反应生成氯化铜和水;
C.碳酸钙为沉淀,应保留化学式;
D.漏掉钡离子与硫酸根离子的反应.
解答 解:A.铜和稀硫酸不反应,故A错误;
B.氢氧化铜溶于盐酸,离子方程式:Cu(OH)2+2H+═Cu2++2H2O,故B正确;
C.碳酸钙与稀盐酸反应,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故C错误;
D.硫酸与氢氧化钡溶液反应,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应必须遵循客观事实,题目难度不大.

练习册系列答案
相关题目
19.下列反应的离子方程式,正确的是( )
| A. | Fe2O3溶于过量的氢酸碘中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+CO32- | |
| C. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
4.在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)?mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)m=2,表中b<c(填“<”、“=”或“>”).
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.

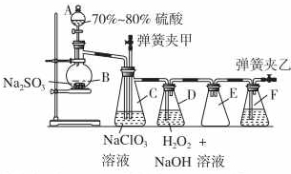 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠. (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z.
 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: