题目内容
铝和钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到了4.48L氢气(标准状态),若钠有0.1mol,则铝的物质的量为 .
考点:有关混合物反应的计算
专题:
分析:根据电子转移守恒计算钠反应生成氢气的物质的量,进而计算Al与氢氧化钠溶液反应生成氢气的物质的量,再根据电子转移守恒计算Al的物质的量.
解答:
解:铝和钠混合物投入足量的水中,钠与水反应生成氢氧化钠与氢气,Al再与氢氧化钠溶液反应生成氢气,生成氢气总物质的量为
=0.2mol,
若钠有0.1mol,根据电子转移守恒,Na反应生成氢气为
=0.05mol,故Al与氢氧化钠溶液反应生成氢气的物质的量为0.2mol-0.05mol=0.15mol,根据电子转移守恒Al的物质的量为
=0.1mol,
故答案为:0.1mol.
| 4.48L |
| 22.4L/mol |
若钠有0.1mol,根据电子转移守恒,Na反应生成氢气为
| 0.1mol×1 |
| 2 |
| 0.15mol×2 |
| 3 |
故答案为:0.1mol.
点评:本题考查混合物计算,明确发生的反应是关键,注意根据电子转移守恒计算,难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
用高铁酸钠(Na2FeO4)对河(湖)水消毒是城市饮水处理的新技术.已知反应:Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是( )
| ||
| A、Na2O2既是氧化剂又是还原剂 |
| B、3 mol Na2O2发生反应,有6mol电子转移 |
| C、在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D、Na2FeO4既是氧化产物又是还原产物 |
下列反应中,观察不到颜色变化的是( )
| A、往氨水中滴加酚酞 |
| B、往稀硫酸中通入氨气 |
| C、往品红溶液中通人足量二氧化硫气体 |
| D、氯气通入淀粉碘化钾溶液中 |
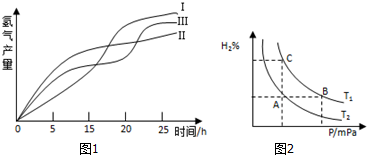
 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.