题目内容
2.0.98gCu(OH)2样品受热分解的热重曲线(样品质量随温度变化的曲线)如图所示.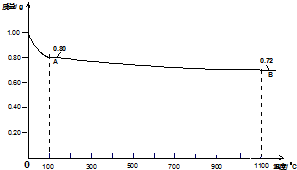
请回答下列问题:
(1)试确定1100℃时所得固体B的化学式(要求写出推理或计算过程).
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体反应,得到红色固体单质和气体单质,则该反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;若反应中转移0.015mol电子,则消耗还原剂的物质的量为0.005mol.
(3)取少量固体B于试管中,加入足量的稀硫酸得到蓝色溶液,同时观察到试管中还有红色固体存在,该反应的离子方程式为Cu2O+2H+═Cu+Cu2++H2O.
分析 (1)由图可知0.98gCu(OH)2即0.01mol,加热至1100°C时失重0.26g,则1mol Cu(OH)2加热至1100°C时失重26g,由此分析求解;
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体是氨气,得到红色固体单质是铜和气体单质是氮气,所以反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;每转移6mol的电子消耗还原剂为2mol,由此分析解答;
(3)取少量固体氧化亚铜于试管中,加入足量的稀硫酸得到蓝色溶液含铜离子,同时观察到试管中还有红色固体存在是单质铜,是酸性条件下+1价铜发生自身的氧化还原反应,离子方程式为Cu2O+2H+═Cu+Cu2++H2O.
解答 解:(1)由图可知0.98gCu(OH)2即0.01mol,加热至1100°C时失重0.26g,则1mol Cu(OH)2加热至1100°C时失重26g,加热时失去的重量应为2molH原子和1.5molO原子,则1molCu(OH)2加热后剩余1molCu和 0.5mol氧原子,Cu与O原子个数比为2:1,故剩余固体化学式为Cu2O,
答:1100℃时所得固体B的化学式Cu2O;
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体是氨气,得到红色固体单质是铜和气体单质是氮气,所以反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;每转移6mol的电子消耗还原剂为2mol,反应中转移0.015mol电子,则消耗还原剂的物质的量为$\frac{2}{6}×0.015$=0.005mol,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O; 0.005mol;
(3)取少量固体氧化亚铜于试管中,加入足量的稀硫酸得到蓝色溶液含铜离子,同时观察到试管中还有红色固体存在是单质铜,是酸性条件下+1价铜发生自身的氧化还原反应,离子方程式为Cu2O+2H+═Cu+Cu2++H2O,故答案为:Cu2O+2H+═Cu+Cu2++H2O.
点评 本题考查化学反应的相关计算,学生要学会分析图象信息完成此类习题是解题的关键所在,有一定的难度.

 名校课堂系列答案
名校课堂系列答案| A. | 氯水 | B. | 硫酸 | C. | 硝酸锌 | D. | 硝酸 |
| A. | 稀氯化钙水溶液中 | B. | 氯化银悬浊液中 | ||
| C. | 二氧化硫与氧气反应的混合物中 | D. | 稀醋酸水溶液中 |
| A. | 溶液中一定有Fe3+ | B. | 溶液中一定无Fe2+ | ||
| C. | 溶液中一定有Fe2+ | D. | 无法确定 |
| A. | 塑化剂和塑料都是高分子化合物 | B. | 聚乙烯塑料属于热固性塑料 | ||
| C. | 塑料中不允许添加任何添加剂 | D. | 塑料和合成橡胶都属于合成材料 |
| A. | 在通常情况下其单质均为气体 | B. | 其单质均由双原子分子组成 | ||
| C. | 都属于非金属元素 | D. | 每种元素都只有一种氢化物 |